题目内容
【题目】为探究锌、铜、铁三种金属的活动性顺序,某学习小组做了如甲图所示实验,实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多(如乙图所示),下列说法正确的是( )
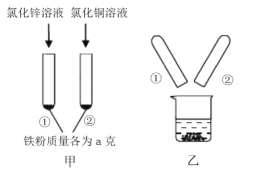
A. 反应后乙烧杯中的固体一定含有铁
B. 甲图试管②中反应后固体一定不含铁
C. 反应后烧杯中的溶液一定不含有氯化铜
D. 烧杯中最后所得固体的质量一定小于 2a 克
【答案】B
【解析】
锌、铁、铜三者的金属活动性依次降低,因此铁可以置换出铜盐中的铜,不能置换出锌盐中的锌,所以在甲图实验中,试管①中不发生反应,试管②中铁将氯化铜中的铜置换出来,由题干“实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多(如乙图所示)”可知,甲图实验中试管②铁反应完全,氯化铜溶液有剩余。
A、反应后烧杯中的固体不一定含有铁,由于不知道烧杯中氯化铜溶液的含量,因此无法确定反应后烧杯中的固体是否含有铁,故不符合题意;
B、由上述推理,可知试管②中应后固体中一定不含有铁,故符合题意;
C、当氯化铜溶液过量,铁不足量时,反应后烧杯中的溶液可能含有氯化铜,故不符合题意;
D、该实验只发生铁和氯化铜反应生成铜和氯化亚铁一种反应,设参与反应的铁的质量为x,由关系式Fe~CuCl2~Cu可知, x克的铁能置换出铜:![]() 克,因此烧杯中最后所得固体的质量为2a-x+
克,因此烧杯中最后所得固体的质量为2a-x+![]() =2a+
=2a+![]() ,即最后所得固体质量一定大于2a克,故不符合题意;
,即最后所得固体质量一定大于2a克,故不符合题意;
故选B。

【题目】在学完酸碱盐的知识后,某兴趣小组开展了如下的探究,请回答相关问题。
(1)向石灰乳中加入一定量的稀盐酸,得到了澄清溶液,写出发生反应的化学方程式:__________________________。已知氯化钙溶液显中性,现用pH计测得反应后的溶液的pH=4.3,则此时溶液里的粒子示意图正确的是_______(填字母序号)。
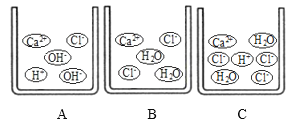
(2)已知常温下氢氧化钙的溶解度为 0.17g。若将石灰乳静置一段时间,则得到的上层澄清液体的溶质质量分数为_____(精确到 0.01%)。
(3)向石灰石中加入稀硫酸,发现反应缓慢,如何提高该反应速率呢?
查阅资料:石灰石与稀硫酸反应生成 CaSO4,同时产生CO2气体;且CaSO4 微溶于水。
Ⅰ.甲同学认为可以用增大稀硫酸浓度的方法来提高该反应速率。取相同质量相同规格的石灰石进行了如下实验:
实验 | ①10%硫酸溶液 | ②20%硫酸溶液 | ③40%硫酸溶液 |
观察1分钟内石灰石表面的气泡放出快慢 | 缓慢 | 明显加快 | 开始很快、又迅速变慢 |
由上述实验现象可知,增大稀硫酸的浓度_____(填“一定”或“不一定”)能提高该反应速率。请推测出现实验③中现象的原因:______________________________
Ⅱ.写出另外一种提高该反应速率方法:_____________________________。