题目内容
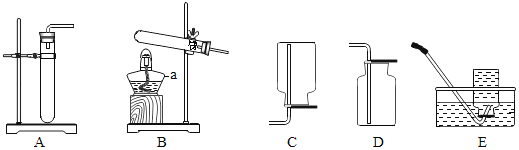
【题目】某金属冶炼厂的工业废渣中含有泥沙和某些单质,其中单质含有铜、锌和少部 分硫.现欲回收铜和锌,并对硫进行处理,主要流程如图所示:
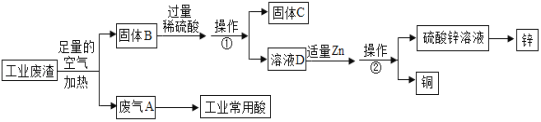
(1)在废气 A 中,一定含有的有害气体是_______(填化学式),如果该气体泄漏到大气中 会导致的后果是造成______________
(2)操作①的操作名称是_______,溶液 D 中含有的溶质是_______________ (填化学式).
(3)写出加入过量稀硫酸后发生的化学方程式(写出其中之一即可)______________
【答案】SO2 酸雨 过滤 H2SO4、CuSO4、ZnSO4 CuO+H2SO4═CuSO4+H2O(或ZnO+H2SO4═ZnSO4+H2O)
【解析】
(1)在空气中加热时,硫能和氧气反应生成二氧化硫,在废气A中一定含有的有害气体是二氧化硫,化学式为:SO2;二氧化硫在空气中易形成硫酸,该气体泄漏到大气中 会导致的后果是造成酸雨;
(2)根据流程图可知,操作①能将固体与液体分开,操作①的操作名称是过滤;铜、锌在空气中加热分别生成氧化铜和氧化锌,固体B中存在氧化铜和氧化锌,氧化铜和氧化锌能与硫酸反应,分别生成硫酸铜和硫酸锌,溶液D中含有的溶质是硫酸铜、硫酸锌和过量的硫酸,硫酸、硫酸铜和硫酸锌的化学式是:H2SO4、CuSO4、ZnSO4;
(3)由固体B生成溶液D的过程中,稀硫酸和氧化铜反应生成硫酸铜和水,和氧化锌反应生成硫酸锌和水,反应的化学方程式分别为:CuO+H2SO4═CuSO4+H2O,ZnO+H2SO4═ZnSO4+H2O。

【题目】碳酸钠广泛用于造纸、纺织、玻璃、洗涤剂、肥皂、制革等工业,是一种重要的化工原料。吕布兰、索尔维和侯德榜为碳酸钠的工业化生产作出了巨大贡献。
I、吕布兰法
1789年,法国医生吕布兰 (N.Leblanc,1742﹣1806)以食盐、浓硫酸、木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如图:
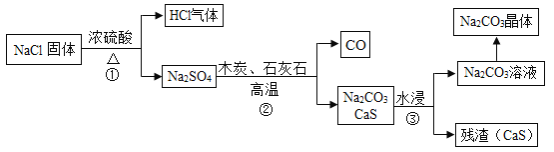
(1)碳酸钠俗称_____。
(2)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为 ___________。
(3)③中“水浸”时通常需要搅拌,其目的是________。
(4)不断有科学家对吕布兰法进行改进,是因为此法有明显不足,请写出一条不足之处______。
Ⅱ、索尔维法
1892年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。原理如下:
NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
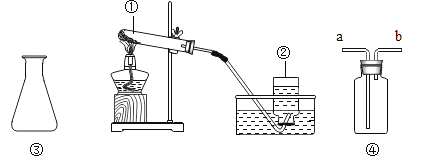
某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。
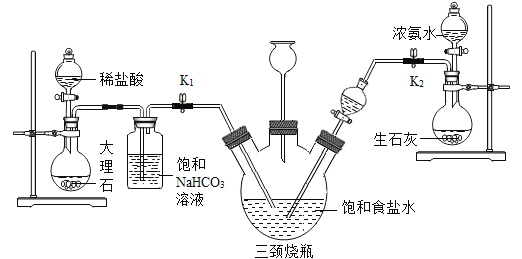
实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
请回答下列问题:
(5)饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为_____;
(6)三颈烧瓶上连接的长颈漏斗的主要作用是_____
(7)①根据实验记录,计算t2时 NaHCO3固体的分解率 (已分解的 NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程_________。
②若加热前NaHCO3固体中还存在少量NaCl,上述计算结果将_____ (填“偏大”、“偏小或“无影响”)。
(8)制碱技术在很长一段时间内把持在英、法等西方国家手中,我国化学工程专家侯德榜先生独立摸索出索尔维法并公布与众,又于1943年创造性地将制碱与制氨两种工艺联合起来,基本消除废弃物的排放,同时生产出碳酸钠和氯化铵两种产品,这就是著名的侯氏制碱法。下列认识或理解正确的是_____
①科学认识是在曲折的、艰辛的积累过程中不断进步的;
②“科技兴邦、实业救国”是侯德榜先生回国研究的巨大动力;
③侯氏制碱法大大提高了原料的利用率,它符合当今“绿色化学”的理念。
【题目】某实验小组利用废硫酸液制备K2SO4
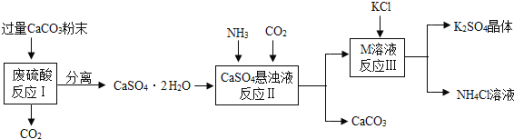
(1)将CaCO3研成粉末的目的是 .
(2)上述流程中可循环使用的物质有CO2和 (填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入 (选填序号,下同),振荡、静置,再向上层清液中滴加 ,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液