题目内容
H2是一种重要的化工生产原料,也是一种极具开发前景的清洁能源。实验室常用锌粒与稀硫酸反应来制取H2,以便研究H2的性质,下面是一些常见的化学仪器或装置,请按要求填空:
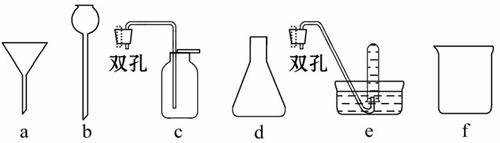
(1)写出上述仪器的名称:b___________,f___________;
(2)选取上述仪器中的__________(填字母代号)组装成制备和收集H2的装置;
(3)为安全起见,在点燃氢气之前,必须进行的操作是___________________;
(4)此套制备H2的装置________(选填“能”或“不能”)制备O2,如果能,请写出用其制备O2反应的化学方程式;如果不能,说明理由:_________________。
【解析】制取H2的药品为锌与稀硫酸,收集方法为排水法或向下排空气法,故采用的装置为b、d、e;这些仪器组成的装置适宜固液不加热条件下的反应,所以可以用双氧水和二氧化锰的混合物制取氧气。
答案:(1)长颈漏斗 烧杯 (2)b、d、e (3)验纯
(4)能 2H2O2 2H2O+O2↑
2H2O+O2↑

练习册系列答案
相关题目
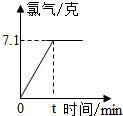 氯化钠是一种重要的化工原料.电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应为:2NaCl+2H2O
氯化钠是一种重要的化工原料.电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应为:2NaCl+2H2O

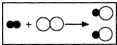 (2006?山西)如图是某气体在另一种气体中燃烧的微观示意图,其中○和●分别表示氯原子和氢原子.请回答:
(2006?山西)如图是某气体在另一种气体中燃烧的微观示意图,其中○和●分别表示氯原子和氢原子.请回答: 些常见的化学仪器或装置,请按要求填空:
些常见的化学仪器或装置,请按要求填空: 