题目内容
【题目】为获得单质钯(Pd), 取100 g17.7%的PdCl2溶液,加入10.0g金属钴(Co) 粉,使其充分反应,得到Pd和钴的氯化物溶液。经分析,得知未反应的Co粉质量为4.1 g。下列说法不正确的是
A.所得溶液中溶质的质量为13 g
B.所得溶液的质量为99.4 g
C.所得溶液为CoCl3溶液.
D.得到Pd的质量为10.6g
【答案】BC
【解析】
根据PdCl2中氯元素的质量在反应前后不变,反应的Co的质量,推断出两元素对应的原子个数之比,进而可推断出钴的氯化物的化学式和反应的化学方程式,进而分析溶液质量等。
参加反应的钴的质量为10.0g-4.1g=5.9g
100 g17.7%的PdCl2溶液中,PdCl2的质量=100g×17.7%=17.7g;
17.7gPdCl2中氯元素的质量=![]() =7.1g
=7.1g
根据反应前后,氯元素的质量不变,生成的钴的氯化物中,钴元素的质量是5.9g,氯元素的质量是7.1g,则钴的氯化物中钴原子与氯原子的个数比=![]() =1:2,则钴的氯化物的化学式是CoCl2,则反应的化学方程式是
=1:2,则钴的氯化物的化学式是CoCl2,则反应的化学方程式是![]() ;
;
设5.9g钴与PdCl2溶液完全反应,生成的Pd的质量为x
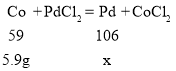
![]()
X=10.6g
即生成Pd的质量为10.6g
设生成的氯化钴的质量为y
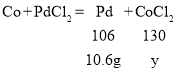
![]()
y=13g
即所得溶液中溶质的质量为13 g
A、所得溶液中溶质的质量为13g,故选项A正确;
B、所得溶液质量为100g+(10.0g-4.1g)-10.6g=95.3g,故选项B不正确;
C、根据分析所得溶液是CoCl2溶液,而不是CoCl3溶液,故选项C不正确;
D、根据计算,得到Pd的质量为10.6g,故选项D正确。
故选:BC.

【题目】化学语言是化学学习的重要工具。
(1)根据下表提供的信息,按要求填空。
化学 符号 | 2H2 | ②____ | 氦气 | ④_____ | ⑤________ |
符号的 意义 | ①____ | 3个 氢氧根离子 | ③______ | 氧化铁中铁元素的化合价为+3价 | 碳酸钠 |
(2)现有H、C、O、N四种常见的元素,请选用其中的元素写出符合下列要求的物质各一种(用化学式表示):
①空气中含量最多的物质________;
②天然气的主要成分___________;
③具有还原性且有毒的气体___________;
④酒精灯内的燃料_____________。