题目内容
【题目】根据如图所示的信息计算: 反应的方程式为:2KOH+H2SO4=K2SO4+H2O。

(1)加入的稀硫酸质量为_______________g。
(2)所用稀硫酸溶质的质量分数__________________。(写出计算过程)
【答案】24.5 20%
【解析】
根据质量守恒定律可求加入硫酸溶液的质量,根据氢氧化钾的质量和对应的化学方程式求算所用稀硫酸溶质的质量分数。
(1)根据质量守恒定律可得,加入的硫酸溶液的质量为80.5g-56g=24.5g。
(2)消耗的KOH的质量为10%×56g=5.6g,设所用稀硫酸溶质的质量分数为x,
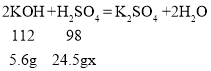
![]()
x=20%;
答:(1)加入的稀硫酸质量为 24.5g;
(2)所用稀硫酸溶质的质量分数为20%。

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目