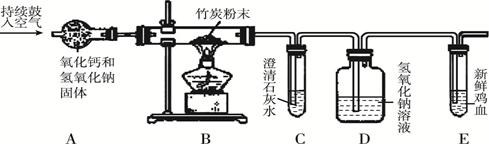
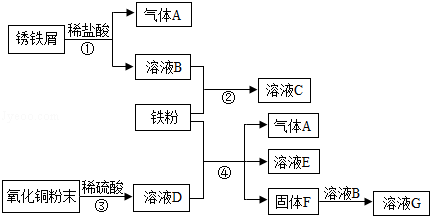
题目内容
有一瓶无色透明溶液,其溶质为BaCl2、Na2CO3、Ca(OH)2、Na2SO4中的一种,取少量该溶液于试管中,加入Ba(NO3)2溶液后发生复分解反应,有白色沉淀生成.
(1)从上述实验中能否确定该溶液中的溶质是哪一种物质? (填“能”或“不能”)
(2)向上述试管中继续加入稀盐酸,白色沉淀完全消失,同时有气体冒出.由此可得出什么结论?
(3)写出上述实验过程中发生化学反应的化学方程式.
(1)从上述实验中能否确定该溶液中的溶质是哪一种物质? (填“能”或“不能”)
(2)向上述试管中继续加入稀盐酸,白色沉淀完全消失,同时有气体冒出.由此可得出什么结论?
(3)写出上述实验过程中发生化学反应的化学方程式.
(1)不能;(2)溶液中没有Na2SO4,有Na2CO3;(3)Na2CO3+Ba(NO3)2═2NaNO3+BaCO3↓;BaCO3+2HCl═BaCl2+H2O+CO2↑;
试题分析:(1)Ba(NO3)2与Na2CO3反应生成碳酸钡沉淀和硝酸钠,Ba(NO3)2与Na2SO4发生复分解反应生成硫酸钡沉淀和硝酸钠,所以不能确定溶液中的溶质.(2)碳酸钡和盐酸反应生成可溶的氯化钡、水和二氧化碳,硫酸钡与盐酸不反应,若存在着Na2SO4,沉淀不溶解,若存在着Na2CO3,白色沉淀消失并有气体冒出.(3)上述各步中涉及的化学反应有两个,Ba(NO3)2与Na2CO3反应生成碳酸钡沉淀和硝酸钠,方程式为:Ba(NO3)2+Na2CO3=2NaNO3+BaCO3↓;碳酸钡和盐酸反应生成可溶的氯化钡、水和二氧化碳,方程式:BaCO3+2HCl═BaCl2+H2O+CO2↑.

练习册系列答案
相关题目
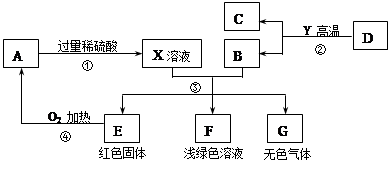
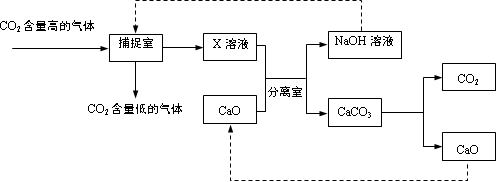
 CO2 → Na2CO3
CO2 → Na2CO3