��Ŀ����
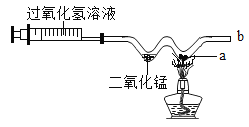
����Ŀ��ij�ع涨:��ҵ�ŷŵ�����SO2�ĺ���������0.4mgL-1,ij��ȤС�����÷�ӦSO2+l2+2H2O=H2SO4+2HI,�ⶨij��ҵ������SO2�ĺ���,����װ����ͼ��ʾ��

���Բ���:
�ٵ���Һ�����ƣ�ȷ��ȡ1.27g�ⵥ�ʣ����������⻯�أ����ܽ���100mLˮ��,����ˮ���Ƴ�1000mL��Һ��
��ȡ5mL������Һ�������Թ��У�����2~3�ε�����Һ����Һ������
�۰�100mLע�����Ļ����Ƶ���,�����Թܵ���Ƥ����,��ͼ��ʾ��Ȼ��������ע����,ÿ�γ�ȡ������Ϊ100mL,�ظ���ȡn��,ֱ����Һ��Ϊ��ɫ(�����е������ɷֲ�����۵���Һ��Ӧ)��
(1)�������,5mL��Һ�����еⵥ��_______mg��������л���������ע����������������Ŀ����_______,
(2)���������ij��ҵ����,��ȡ����Ϊ80�κ�,��Һ�պñ�Ϊ��ɫ���Լ���÷�����SO2����,���ж��Ƿ�����ŷű���__________________________
���𰸡� 6.35mg ʹ���������ַ�Ӧ 0.2mg/L<0.4mg/L���ŷŴ��
��������
��1��5mL��Һ�����еⵥ��Ϊ![]() ��������л���������ע����������������Ŀ����ʹ���������ַ�Ӧ����2�����80�η����ж������������Ϊ��
��������л���������ע����������������Ŀ����ʹ���������ַ�Ӧ����2�����80�η����ж������������Ϊ��
SO2+l2+2H2O=H2SO4+2HI
64 254
![]() 6.35mg
6.35mg
![]()
��ã�![]() =1.6mg
=1.6mg
���Է����ж�������ĺ���Ϊ![]() ��
��
0.2mg/L<0.4mg/L���ŷŴ�ꡣ

 �ǻۿ����ܾ�100�ֵ�Ԫ���ؼ��ϵ�д�
�ǻۿ����ܾ�100�ֵ�Ԫ���ؼ��ϵ�д� ��Ԫ������ĩ��ϵ�д�
��Ԫ������ĩ��ϵ�д�