题目内容
【题目】某天化学兴趣小组听老师讲:“浓硫酸滴在衣服上很快出现洞洞眼眼,还有刺激性气味产生”。兴趣小组结合浓硫酸的性质思考,难道浓硫酸能与碳单质反应?若反应,会生成什么呢?
[查阅资料]:
①SO2能使澄清石灰水变浑浊 Ca(OH)2 + SO2 = CaSO3↓ + H2O ;
②SO2能使品红溶液褪色,用于检验SO2存在;
③SO2能与溴水反应而被吸收 SO2 + Br2 + 2H2O = H2SO4 + 2HBr 。
[提出猜想]:
 从物质组成元素看,可能生成H2、CO2、CO、SO2气体及H2O;
从物质组成元素看,可能生成H2、CO2、CO、SO2气体及H2O;
[实验步骤]:
实验小组设计了如下步骤:
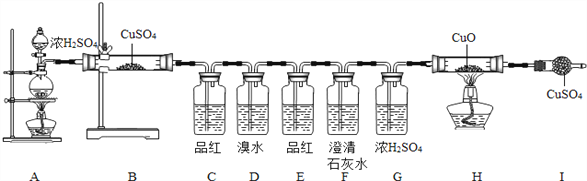
(1)按上述图示安装好仪器;(2)检查气密性;(3)加入对应药品,并将浓H2SO4放入烧杯中;(4)加热A,加热H;(5)停止加热。
[实验分析]:
(1)B装置的作用是________________________________________。
(2)C装置的作用是________________________________________。
(3)D装置的作用是________________________________________。
(4)E装置的作用是________________________________________。
[实验结论]:
(1)B处固体由白色变蓝色,说明有_______(填化学式,下同)生成;C处品红溶液褪色,说明有______生成;F处澄清石灰水变浑浊,说明有______生成;则产生浑浊的化学方程式为________;H、I处无现象,说明无_____________生成。
(2)浓硫酸能与碳单质反应,其化学方程式为____________________________________。
【答案】 检验产物中是否水蒸气 检验产物中是否有二氧化硫气体 吸收(除去)产物中的二氧化硫气体 检验二氧化硫是否被除尽 H2O SO2 CO2 Ca(OH)2 + CO2 = CaCO3↓ + H2O H2和CO C+2H2SO4(浓) △ 2S02↑+C02↑+2H2O
【解析】[实验分析]:(1)固体由白色变蓝色,说明有H2O生成,故作用:检验产物中是否水蒸气;(2)因为SO2能使品红溶液褪色,所以C处品红溶液褪色,说明有二氧化硫生成,故作用:检验产物中是否有二氧化硫气体;(3)SO2能在D装置中与溴水反应而被吸收,故作用:吸收(除去)产物中的二氧化硫气体;(4)因为SO2能在D装置中与溴水反应而被吸收,所以E处,品红溶液不褪色,说明二氧化硫已经被除尽,故作用:检验二氧化硫是否被除尽;[实验结论]:(1)B处,固体由白色变蓝色,说明有H2O生成;因为SO2能使品红溶液褪色,所以C处品红溶液褪色,说明有二氧化硫生成;因为二氧化硫已经被除尽,而F处澄清石灰水变浑浊,说明有二氧化碳气体的产生,发生反应的方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;综合分析实验现象可以看出产生的气体有H2O和SO2、CO2,无CO、H2;(2)因此浓硫酸和碳反应的方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。

【题目】硅钢是制变压器、充电器的核心材料,其主要成分是Fe和Si。某同学用硅钢样品进行如下实验:取6.60 g硅钢样品,将60.00 g稀硫酸分6次加入样品中(其中稀硫酸与硅及其他杂质不反应)。实验测得相关数据如下:
稀硫酸的用量 | 剩余固体的质量 |
第1次加入10.00 g | W g |
第2次加入10.00 g | 4.36 g |
第3次加入10.00 g | 3.24 g |
第4次加入10.00 g | 2.12 g |
第5次加入10.00 g | 1.00 g |
第6次加入10.00 g | 1.00 g |
(1)根据表中数据,稀硫酸加入到第________次,铁恰好反应完全。
(2)表中W=________g。
(3)计算该稀硫酸溶质的质量分数(写出计算过程)。


