题目内容
(2009?通州区二模)关于金属及金属材料,你一定有不少认识,请你回答下列问题:
(1)下列各图为常见的金属应用实例,它们应用金属的三点物理特性是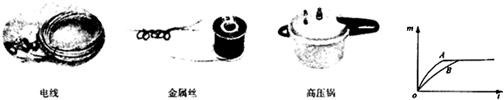
(2)小军家的一件铜器原来是呈光亮的红色,放置一段时间后发现表面出现了绿色,为此他查阅资料发现:“这是铜在潮湿的环境中生锈的缘故,铜锈的化学名称叫碱式碳酸铜(Cu2(OH)2CO3),他受热后可分解成氧化铜、二氧化碳和水.”
①你认为铜锈中一定含有的元素是
②生成铜锈时,有关反应物除铜以外还一定有的是
③铜锈加热分解时的化学方程式为
(3)如图是某课外活动小组的同学,在用相同质量的铁和锌粒跟一定量稀盐酸反应的过程记录,其中横坐标表示反应的时间,纵坐标表示产生氢气的质量,试回答:
①曲线A表示的是
②上述曲线图除能说明①的结论外,还可以得出的另外两个结论是
(1)下列各图为常见的金属应用实例,它们应用金属的三点物理特性是
导电性、延展性、导热性
导电性、延展性、导热性
.
(2)小军家的一件铜器原来是呈光亮的红色,放置一段时间后发现表面出现了绿色,为此他查阅资料发现:“这是铜在潮湿的环境中生锈的缘故,铜锈的化学名称叫碱式碳酸铜(Cu2(OH)2CO3),他受热后可分解成氧化铜、二氧化碳和水.”
①你认为铜锈中一定含有的元素是
Cu、O、H、C
Cu、O、H、C
(填写符号);②生成铜锈时,有关反应物除铜以外还一定有的是
二氧化碳和水
二氧化碳和水
;③铜锈加热分解时的化学方程式为
Cu2(OH)2CO3
2CuO+CO2↑+H2O
| ||
Cu2(OH)2CO3
2CuO+CO2↑+H2O
;
| ||
(3)如图是某课外活动小组的同学,在用相同质量的铁和锌粒跟一定量稀盐酸反应的过程记录,其中横坐标表示反应的时间,纵坐标表示产生氢气的质量,试回答:
①曲线A表示的是
锌
锌
跟稀盐酸反应的情况,有关的化学方程式为Zn+2HCl═ZnCl2+H2↑
Zn+2HCl═ZnCl2+H2↑
.②上述曲线图除能说明①的结论外,还可以得出的另外两个结论是
反应生成了相同质量的氢气
反应生成了相同质量的氢气
;该实验中金属铁有剩余
该实验中金属铁有剩余
.分析:(1)根据金属具有的特性进行解答;
(2)根据铜锈的化学式可知其元素组成、由质量守恒定律可推知参加反应的物质以及碱式碳酸铜(Cu2(OH)2CO3)受热分解生成氧化铜、二氧化碳和水进行解答;
(3)根据金属A所利用的时间比金属B的少(即金属A的反应速度比金属B的快)进行解答;
(2)根据铜锈的化学式可知其元素组成、由质量守恒定律可推知参加反应的物质以及碱式碳酸铜(Cu2(OH)2CO3)受热分解生成氧化铜、二氧化碳和水进行解答;
(3)根据金属A所利用的时间比金属B的少(即金属A的反应速度比金属B的快)进行解答;
解答:解:(1)电线利用金属的导电性;金属丝是利用金属的延展性;高压锅是利用金属的导热性;
(2)①铜锈的化学名称叫碱式碳酸铜,化学式为Cu2(OH)2CO3,铜锈中一定含有的元素是铜、氧、氢、碳元素;②铜锈中含有的元素是铜、氧、氢、碳元素,由质量守恒定律可推知生成铜锈时,反应物除铜以外还一定有的是水和二氧化碳;③碱式碳酸铜(Cu2(OH)2CO3)受热分解生成氧化铜、二氧化碳和水,化学方程式为:Cu2(OH)2CO3
2CuO+CO2↑+H2O;
(3)①根据图示可知,在它们停止反应时,金属A所利用的时间比金属B的少(即金属A的反应速度比金属B的快),说明金属A的活动性大于金属B,又因锌的活动性比铁强,所以曲线A为锌;锌和盐酸反应生成氯化锌和氢气,化学方程式为Zn+2HCl═ZnCl2+H2↑;
②图示曲线上待反应停止后,所得氢气质量相等,而相同质量的铁、锌完全反应铁生成氢气量大于锌,所以可以得出铁未完全反应或两种金属均未完全反应的结论;
故答案为:(1)导电性、延展性、导热性;(2)①Cu、O、H、C;②二氧化碳和水;③Cu2(OH)2CO3
2CuO+CO2↑+H2O;(3)①锌;Zn+2HCl═ZnCl2+H2↑;②反应生成了相同质量的氢气;该实验中金属铁有剩余.
(2)①铜锈的化学名称叫碱式碳酸铜,化学式为Cu2(OH)2CO3,铜锈中一定含有的元素是铜、氧、氢、碳元素;②铜锈中含有的元素是铜、氧、氢、碳元素,由质量守恒定律可推知生成铜锈时,反应物除铜以外还一定有的是水和二氧化碳;③碱式碳酸铜(Cu2(OH)2CO3)受热分解生成氧化铜、二氧化碳和水,化学方程式为:Cu2(OH)2CO3
| ||
(3)①根据图示可知,在它们停止反应时,金属A所利用的时间比金属B的少(即金属A的反应速度比金属B的快),说明金属A的活动性大于金属B,又因锌的活动性比铁强,所以曲线A为锌;锌和盐酸反应生成氯化锌和氢气,化学方程式为Zn+2HCl═ZnCl2+H2↑;
②图示曲线上待反应停止后,所得氢气质量相等,而相同质量的铁、锌完全反应铁生成氢气量大于锌,所以可以得出铁未完全反应或两种金属均未完全反应的结论;
故答案为:(1)导电性、延展性、导热性;(2)①Cu、O、H、C;②二氧化碳和水;③Cu2(OH)2CO3
| ||
点评:解答本题要掌握化学方程式的书写方法和探究实验的设计特点,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目