题目内容
为了测定黄铜屑(有锌和铜形成的合金)样品组成,甲、乙、丙、丁四位同学分别取样和稀硫酸反应(稀硫酸的密度为1.17g/mL),实验数据记录如下:
| 甲 | 乙 | 丙 | 丁 | |
| 取用黄铜屑的质量/g | 16.0 | 16.0 | 16.0 | 24.0 |
| 取用稀硫酸的体积/mL | 16.0 | 32.0 | 48.0 | 一定体积 |
| 残留金属的质量/g | 13.4 | 10.8 | 9.6 | 16.2 |
(1)16.0g黄铜屑中锌的质量.
(2)丁同学所加稀硫酸的体积.
解:(1)从甲、乙、丙三位同学取稀硫酸的体积及残留金属的质量分析,丙同学取用硫酸过量.
所以,16.0g黄铜屑中锌的质量为:16.0g-9.6g=6.4g
(2)设甲同学消耗硫酸的质量为x
H2SO4+Zn=ZnSO4+H2↑
98 65
x 16.0g-13.4g

x=3.92g
稀硫酸的溶质质量分数为: ×100%=20.9%
×100%=20.9%
丁同学消耗锌的质量分数为:24.0g-16.2g=7.8g,比丙同学的实验数据16.0g黄铜含铜9.6g,则24.g黄铜含铜14.4g,可知丁同学所取的一定体积的稀硫酸完全反应;设丁同学实验消耗H2SO4的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 98
7.8g y
 ,y=11.76g
,y=11.76g
所以,丁同学取用稀硫酸的质量为 =56.27g
=56.27g
体积为: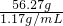 =48mL
=48mL
答:(1)16.0g黄铜屑中锌的质量为6.4g;(2)丁同学所加稀硫酸的体积为48mL.
分析:根据金属活动性的强弱关系锌>氢>铜,把黄铜屑放入稀硫酸中,锌与硫酸反应生成硫酸锌和氢气,铜不与硫酸反应;
根据甲、乙、丙三位同学的实验数据,随稀硫酸量的增加残留金属质量在减小,且可得知每加入16.0mL稀硫酸金属质量减少16.0g-13.4g=2.6g,但丙同学的使用48.0mL稀硫酸时金属减少量16.0g-9.6g=6.4g<7.8g(2.6g×3),说明此时硫酸过量金属锌已完全反应,残留金属为不与硫酸反应的铜;而甲、乙同学的实验则是硫酸完全反应金属锌过量;
丁同学实验中金属质量减少24.0g-16.2g=7.8g,对比丙同学的实验数据16.0g黄铜含铜9.6g,则24.g黄铜含铜14.4g,可知丁同学所取的一定体积的稀硫酸完全反应,金属锌过量.可根据反应的化学方程式,利用消耗金属锌的质量计算一定体积稀硫酸的质量,再使用m=ρV求出稀硫酸的体积.
点评:利用实验数据中变化量的变化关系,分析反应的进行情况,对后面的计算时数据选择起着决定性作用;只有使用物质完全反应时的实验数据进行计算才能得到正确的结果.
所以,16.0g黄铜屑中锌的质量为:16.0g-9.6g=6.4g
(2)设甲同学消耗硫酸的质量为x
H2SO4+Zn=ZnSO4+H2↑
98 65
x 16.0g-13.4g

x=3.92g
稀硫酸的溶质质量分数为:
 ×100%=20.9%
×100%=20.9%丁同学消耗锌的质量分数为:24.0g-16.2g=7.8g,比丙同学的实验数据16.0g黄铜含铜9.6g,则24.g黄铜含铜14.4g,可知丁同学所取的一定体积的稀硫酸完全反应;设丁同学实验消耗H2SO4的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 98
7.8g y
 ,y=11.76g
,y=11.76g所以,丁同学取用稀硫酸的质量为
 =56.27g
=56.27g体积为:
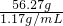 =48mL
=48mL答:(1)16.0g黄铜屑中锌的质量为6.4g;(2)丁同学所加稀硫酸的体积为48mL.
分析:根据金属活动性的强弱关系锌>氢>铜,把黄铜屑放入稀硫酸中,锌与硫酸反应生成硫酸锌和氢气,铜不与硫酸反应;
根据甲、乙、丙三位同学的实验数据,随稀硫酸量的增加残留金属质量在减小,且可得知每加入16.0mL稀硫酸金属质量减少16.0g-13.4g=2.6g,但丙同学的使用48.0mL稀硫酸时金属减少量16.0g-9.6g=6.4g<7.8g(2.6g×3),说明此时硫酸过量金属锌已完全反应,残留金属为不与硫酸反应的铜;而甲、乙同学的实验则是硫酸完全反应金属锌过量;
丁同学实验中金属质量减少24.0g-16.2g=7.8g,对比丙同学的实验数据16.0g黄铜含铜9.6g,则24.g黄铜含铜14.4g,可知丁同学所取的一定体积的稀硫酸完全反应,金属锌过量.可根据反应的化学方程式,利用消耗金属锌的质量计算一定体积稀硫酸的质量,再使用m=ρV求出稀硫酸的体积.
点评:利用实验数据中变化量的变化关系,分析反应的进行情况,对后面的计算时数据选择起着决定性作用;只有使用物质完全反应时的实验数据进行计算才能得到正确的结果.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
为了测定黄铜屑(有锌和铜形成的合金)样品组成,甲、乙、丙、丁四位同学分别取样和稀硫酸反应(稀硫酸的密度为1.17g/mL),实验数据记录如下:
计算:
(1)16.0g黄铜屑中锌的质量.
(2)丁同学所加稀硫酸的体积.
| 甲 | 乙 | 丙 | 丁 | |
| 取用黄铜屑的质量/g | 16.0 | 16.0 | 16.0 | 24.0 |
| 取用稀硫酸的体积/mL | 16.0 | 32.0 | 48.0 | 一定体积 |
| 残留金属的质量/g | 13.4 | 10.8 | 9.6 | 16.2 |
(1)16.0g黄铜屑中锌的质量.
(2)丁同学所加稀硫酸的体积.
为了测定黄铜屑(有锌和铜形成的合金)样品组成,甲、乙、丙、丁四位同学分别取样和稀硫酸反应(稀硫酸的密度为1.17g/mL),实验数据记录如下:
| 甲 | 乙 | 丙 | 丁 | |
| 取用黄铜屑的质量/g | 16.0 | 16.0 | 16.0 | 24.0 |
| 取用稀硫酸的体积/mL | 16.0 | 32.0 | 48.0 | 一定体积 |
| 残留金属的质量/g | 13.4 | 10.8 | 9.6 | 16.2 |
根据上表数据计算:
(1)16.0g黄铜屑中锌的质量;
(2)丁同学所加稀硫酸的体积。
为了测定黄铜屑(有锌和铜形成的合金)样品组成,甲、乙、丙、丁四位同学分别取样和稀硫酸反应(稀硫酸的密度为1.17g/mL),实验数据记录如下:
| 甲 | 乙 | 丙 | 丁 | |
| 取用黄铜屑的质量/g | 16.0 | 16.0 | 16.0 | 24.0 |
| 取用稀硫酸的体积/mL | 16.0 | 32.0 | 48.0 | 一定体积 |
| 残留金属的质量/g | 13.4 | 10.8 | 9.6 | 16.2 |
求:(1)16.0g黄铜屑中锌的质量为多少g ?
(2)丁同学所加稀硫酸的体积为多少 mL ?