题目内容
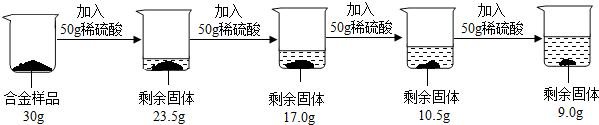
某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品10.0 g放入烧杯中,然后将56.0 g溶质质量分数为14.0%的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应。实验数据记录如下表:
| 编号 | 1 | 2 | 3 | 4 |
| 加入硫酸的质量/g | 14 | 14 | 14 | 14 |
| 剩余固体的质 | 8.7 | 7.4 | 6.1 | 6.0 |
试求:
(1)该合金中铜的质量分数是________。
(2)该合金除铜外,另一种金属是什么呢?(写出过程)
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?(写出计算过 程,结果精确到0.1%)
程,结果精确到0.1%)
答案:(1)60.0%
(2)设M金属单质的相对原子质量为x。
M + H2SO4===MSO4+H2↑
x 98
10.0 g-6.1 g 42.0 g×14.0%
x∶98=3.9 g∶(42.0 g×14.0%) x=65
该金属是锌。
(选取第一次或第二次实验的数据计算且正确也可以)
(3)设第三次所得溶液中ZnSO4的质量为y,生成H2的质量为z。
Zn+H2SO4===ZnSO4+H2↑
98 161 2
42.0 g×14.0% y z
98∶161=(42.0 g×14.0%)∶y y=9.66 g
98∶2=(42.0 g×14.0%)∶z z=0.12 g
ZnSO4溶液中溶质质量分数为:
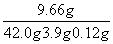 ×100%≈21.1%。
×100%≈21.1%。
其他合理答案也可。

练习册系列答案
相关题目
某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品10.0g放入烧杯中,然后将56.0g溶质质量分数为14.0%的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应.实验数据记录如下表:
试求:
(1)该合金中铜的质量分数是 .
(2)该合金除了铜外,另一种金属的是什么呢?(写出过程)
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?(写出计算过程,结果精确到0.1%)
| 编 号 | 1 | 2 | 3 | 4 |
| 加入硫酸的质量/g | 14 | 14 | 14 | 14 |
| 剩余固体的质量/g | 8.7 | 7.4 | 6.1 | 6.0 |
(1)该合金中铜的质量分数是
(2)该合金除了铜外,另一种金属的是什么呢?(写出过程)
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?(写出计算过程,结果精确到0.1%)