题目内容
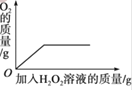
【题目】在含氯化钠杂质的纯碱13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量关系如图所示:
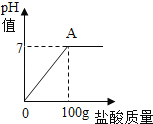
(1)图像中,在____点,反应恰好完全反应,此点溶液中的溶质是_________。
(2)请计算该样品中纯碱的质量分数_______。(写出完整计算过程)
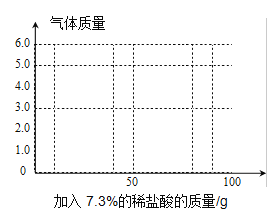
(3)在向样品中不断加入上述盐酸的过程中,请画出加入稀盐酸的质量与产生气体质量的关系图______。
【答案】A NaCl(或氯化钠) 77.9% 
【解析】
(1)由图可知,含氯化钠杂质的纯碱中逐渐加入稀盐酸,碳酸钠与稀盐酸反应,生成氯化钠、水和二氧化碳,图像中曲线的pH 不断增大,A点pH最大,说明A点碳酸钠与稀盐酸恰好完全反应,故填写:A;
A点碳酸钠与稀盐酸恰好完全反应,溶液中的溶质是生成的氯化钠和纯碱中的氯化钠,故填写:NaCl(或氯化钠);
解:设参加反应的碳酸钠质量为x,生成二氧化碳的质量为y

(2)该样品中纯碱的质量分数:![]()
答:该样品中纯碱的质量分数为77.9%;
(3)碳酸钠与稀盐酸反应生成二氧化碳,因此,当逐渐滴加稀盐酸时,二氧化碳的量不断增加,直到稀盐酸为100g时,碳酸钠与稀盐酸恰好完全反应,通过计算可得,产生4.4g二氧化碳,如果继续滴加稀盐酸,属于稀盐酸过量,二氧化碳量将不再变化,反应在图像上为:


练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
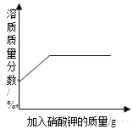
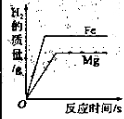
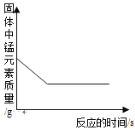
【题目】下列图像能正确反映对应变化关系的是( )
|
|
|
|
A.20℃时,向一定量的硝酸钾不饱和溶液中加入硝酸钾固体 | B.将等质量的镁片和铁片投入到足量稀硫酸中 | C.用酒精灯加热一定量的高锰酸钾固体 | D.向盛有少量二氧化锰的烧杯中不断地加入过氧化氢溶液 |