题目内容
【题目】某化学实验小组对“影响石灰石与盐酸反应速率的因素——盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与。
【进行实验】
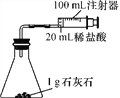
室温下,选用20 mL不同溶质质量分数的盐酸(4%和6%)分别与1 g颗粒状或块状的石灰石进行实验(固定夹持仪器略去)。
(1)石灰石与盐酸反应的化学方程式为____________________________________________________。
(2)按上图装置进行实验,在装药品前应检查该装置的气密性。开始实验时,应将20 mL稀盐酸________(填“快速”或“缓慢”)推入锥形瓶中,以保证盐酸能全部推入锥形瓶中。
【处理数据】
(3)实验小组进行实验后,获得的相关实验数据如下表所示:
实验 编号 | 盐酸溶质质 量分数(均取 20 mL) | 石灰石固 体形状 (均取1 g) | 二氧化碳的 体积(mL)(均 收集前30 s 的气体) |
a | 4% | 颗粒 | 64.0 |
b | 4% | 块状 | 40.4 |
c | 6% | 颗粒 | 98.2 |
d | 6% | 块状 | 65.3 |
①要比较不同溶质质量分数的盐酸对反应速率的影响,可选择的实验编号是________(写一组),由此可得到的结论是____________________________。
②从上述实验中得出石灰石的颗粒大小对反应速率影响的结论是____________________。
【拓展延伸】
(4)下表是实验时记录生成的二氧化碳气体体积和对应的时间的一组实验数据(每间隔4 s读数一次):
时间/s | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 |
气体 体积/ mL | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
从上表数据可以分析得出,到20 s后反应速率逐渐变_______,其主要原因是_____________________。
【答案】 CaCO3+2HCl===CaCl2+H2O+CO2↑ 快速 a和c(或b和d) 盐酸溶质质量分数越大,反应速率越快 石灰石颗粒越小,反应速率越快 慢 随着反应的不断进行,盐酸中溶质的质量分数逐渐减小
【解析】(1)石灰石的主要成分是碳酸钙,与盐酸反应的化学方程式为CaCO3+2HCl===CaCl2+H2O+CO2↑;(2)开始实验时,应将20 mL稀盐酸快速推入锥形瓶中,以保证盐酸能全部推入锥形瓶中;如果缓慢推入,因生成二氧化碳在,装置内压强增大,不易将盐酸全部推入。(3) a和c(或b和d) 都只有盐酸的浓度不同,其它影响反应速率的因素都相同,所以可比较不同溶质质量分数的盐酸对反应速率的影响; (4).根据反应所需要的时间,可知盐酸溶质质量分数越大,反应速率越快; (5). 石灰石颗粒越小,与盐酸接触越充分,反应速率越快; (6). 到20 s后反应速率逐渐变慢 ,原因是随着反应的不断进行,溶液中的溶质越来越少,盐酸中溶质的质量分数逐渐减小,使反应物接触不充分,反应速率就慢了。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案