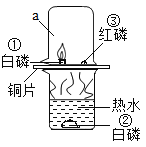
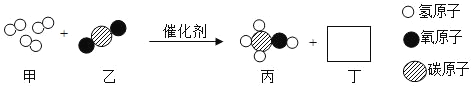
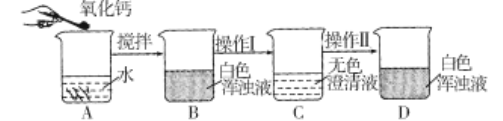
题目内容
【题目】漂白粉的主要成分有Ca(C1O)2、CaCl2,有人提出可以利用海水(含氯NaCl)和石灰石为原料制取漂白粉,该方法流程如下
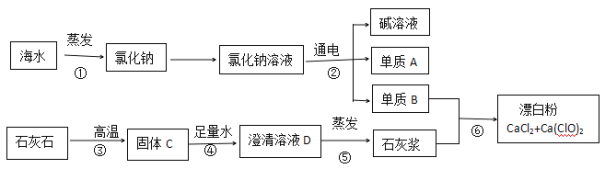
(1)步骤①的蒸发操作中需使用到的玻璃仪器是_______,步骤④需进行的一个操作是_______。
(2)已知单质A是一种可燃性气体,则电解氯化钠溶液的化学方程式为____________。
(3)澄清溶液D的溶质是_______(写化学式):不使用澄清溶液D直接来制取漂白粉,而需使用石灰浆,其原因是_____________________。
(4)制取漂白粉的化学反应为2Ca(OH)2+Cl2=CaCl2+Ca(C1O)2+2H2O,制取“84消毒液”是将氯气(Cl2)通入NaOH溶液中,反应原理与漂白粉的制取相似,请写出该反应的化学方程式:____________。
【答案】玻璃棒 过滤 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ Ca(OH)2 Ca(OH)2微溶于水,溶液中氢氧化钙含量较少,不适合工业上大量制取漂白粉 2NaOH+Cl2=NaCl+NaClO+H2O
2NaOH+H2↑+Cl2↑ Ca(OH)2 Ca(OH)2微溶于水,溶液中氢氧化钙含量较少,不适合工业上大量制取漂白粉 2NaOH+Cl2=NaCl+NaClO+H2O
【解析】
(1)步骤①的蒸发操作中需使用到的玻璃仪器是玻璃棒,过滤可以将不溶性固体从溶液中分离出来,所以步骤④需进行的一个操作是过滤;
(2)氯化钠溶液通电生成碱、单质A和单质B,单质A是一种可燃性气体,根据质量守恒定律和碱概念,可知氯化钠、水在通电的条件下生成氢氧化钠、氯气、氢气,化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(3)碳酸钙在高温的条件下生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,所以澄清溶液D的溶质是Ca(OH)2,氢氧化钙微溶于水,所以不使用澄清溶液D直接来制取漂白粉,而需使用石灰浆,其原因是:Ca(OH)2微溶于水,溶液中氢氧化钙含量较少,不适合工业上大量制取漂白粉;
(4)氢氧化钠和氯气反应生成氯化钠、次氯酸钠和水,化学方程式为:2NaOH+Cl2=NaCl+NaClO+H2O。

【题目】下列对客观事实书写的化学方程式及其反应类型都正确的是( )
选项 | 客观事实 | 化学方程式 | 基本反应类型 |
A | 铁丝在氧气中燃烧 | 2Fe+3O2 | 化合反应 |
B | 加热高锰酸钾 | 2KMnO4 | 分解反应 |
C | 乙醇燃烧 | C2H5OH+3O2 | 氧化反应 |
D | 硫酸钾溶液和氯化钡溶液反应 | K2SO4+BaCl2=2KCl +BaSO4 | 复分解反应 |
A.AB.BC.CD.D