题目内容
【题目】水与人类的生活和生产密切相关,请回答下列问题:
(1)图1是水的电解实验,试管a中产生的气体为 , 该反应的化学方程式为。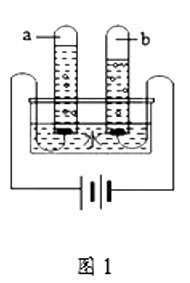
(2)将浑浊的河水用图2所示的简易净水器进行净化,其中活性炭的主要作用是 , 生活中降低水的硬度的方法是。
(3)图3实验中,水的作用为 , 若用pH试纸检测实验结束后集气瓶中液体的pH,则液体的pH7(填“<”或“=”或“>”)。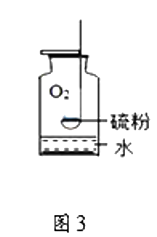
(4)图4为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线.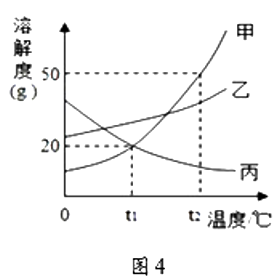
①t1℃时,丙物质的溶解度为;
②t2°C 时将30g甲物质加入到50g水中,充分溶解,所得溶液的质量为 g;
③将t2°C时乙的不饱和溶液逐渐冷却至t1℃,下图中有关量随时间变化的趋势一定错误的是。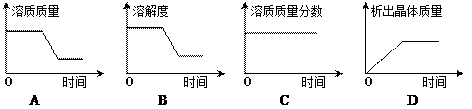
【答案】
(1)氧气(或O2),2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
(2)吸附异味和色素(或吸附),煮沸
(3)吸收生成的二氧化硫,防止污染空气,<
(4)20g,75,BD
【解析】(1). 电解水时正极生成的是氧气,负极生成的是氢气,氢气是氧气体积的2倍; (2).水在通电条件下分解生成氧气和氢气,方程式为 2H2O ![]() 2H2↑+O2↑ (3). 活性炭结构疏松多孔,有吸附性,能吸附异味和色素(或吸附) (4). 硬水是含可溶钙镁化合物较多的水,煮沸可以将硬水中的钙镁化合物转化成沉淀而降低水的硬度。 (5). 水能溶解、反应二氧化硫,达到吸收生成的二氧化硫,防止污染空气的目的 (6).二氧化硫和水反应生成酸,溶液的pH <7; (7). 由图可知,t1℃时,丙物质的溶解度为20g (8). 溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。t2°C 时甲的溶解度为50g,将30g甲物质加入到50g水中,充分溶解,所得溶液的质量为75 (9). 将t2°C时乙的不饱和溶液逐渐冷却至t1℃,溶液由不饱和逐渐成为饱和溶液,继续降温时析出晶体;溶解度受温度影响,温度改变,溶解度相应改变;降温过程中没有晶体析出时,溶液溶质的质量分数不变,析出晶体后质量分析减小;开始降温是没有晶体析出,饱和后继续降温才有晶体析出。
2H2↑+O2↑ (3). 活性炭结构疏松多孔,有吸附性,能吸附异味和色素(或吸附) (4). 硬水是含可溶钙镁化合物较多的水,煮沸可以将硬水中的钙镁化合物转化成沉淀而降低水的硬度。 (5). 水能溶解、反应二氧化硫,达到吸收生成的二氧化硫,防止污染空气的目的 (6).二氧化硫和水反应生成酸,溶液的pH <7; (7). 由图可知,t1℃时,丙物质的溶解度为20g (8). 溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。t2°C 时甲的溶解度为50g,将30g甲物质加入到50g水中,充分溶解,所得溶液的质量为75 (9). 将t2°C时乙的不饱和溶液逐渐冷却至t1℃,溶液由不饱和逐渐成为饱和溶液,继续降温时析出晶体;溶解度受温度影响,温度改变,溶解度相应改变;降温过程中没有晶体析出时,溶液溶质的质量分数不变,析出晶体后质量分析减小;开始降温是没有晶体析出,饱和后继续降温才有晶体析出。
【考点精析】本题主要考查了电解水实验和水的净化的相关知识点,需要掌握电解水的实验:A.装置―――水电解器B.电源种类---直流电C.加入硫酸或氢氧化钠的目的----增强水的导电性D.化学反应:2H2O=== 2H2↑+ O2↑;水的净化效果由低到高的是静置、吸附、过滤、蒸馏(均为物理方法),其中净化效果最好的操作是蒸馏;既有过滤作用又有吸附作用的净水剂是活性炭才能正确解答此题.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案