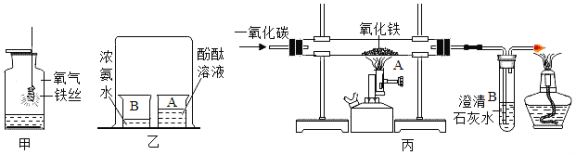
题目内容
【题目】某金属加工厂有大量金属铝、铁、铜的废弃粉末,为充分利用金属资源,分离和回收金属,某化学兴趣小组通过查阅资料设计了如下实验方案:
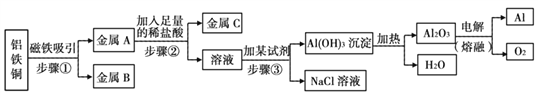
请完成下列各题:
⑴步骤①中分离得到的金属B是________。
⑵步骤②发生的化学反应基本类型是________。
⑶步骤③生成沉淀的化学反应方程式是____________________;因Al(OH)3既能与酸反应又能与碱反应,步骤③加入试剂时应如何操作________________________________。
⑷电解熔融Al2O3制金属铝的化学方程式是_________________________________。
【答案】 铁(或Fe ) 置换反应 3NaOH+AlCl3=Al(OH)3↓+3NaCl 逐滴滴加氢氧化钠溶液并振荡,至沉淀完全 2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
【解析】铝、铁、铜三种金属,只有铁能被磁铁吸引,故金属B是铁;(2)根据金属活动性顺序的应用:位于氢前面的金属能把酸中的氢置换出来生成氢气,由于铜位于氢的后面,故不能和稀盐酸反应,故金属C是铜。铝和稀盐酸反应生成氯化铝和氢气:2Al+6HCl==2AlCl3+3H2↑,该反应的反应物是一种单质和一种化合物,生成物也是一种单质和一种化合物,属置换反应;(3)铝和稀盐酸反应生成氯化铝和氢气,即通过步骤②得到的溶液的氯化铝溶液,氯化铝中加入某种试剂反应得到了氢氧化铝沉淀和氯化钠,故步骤③中加入的是氢氧化钠,氢氧化钠与氯化铝反应生成氢氧化铝沉淀和氯化钠:3NaOH+AlCl3=Al(OH)3↓+3NaCl;因Al(OH)3既能与酸反应又能与碱反应,故加入的氢氧化钠不能过量,即应逐滴滴加氢氧化钠溶液并振荡,至沉淀完全;(4)根据流程图可知电解熔融Al2O3得到的是铝和氧气,故反应的化学方程式表示为:2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。