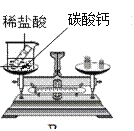
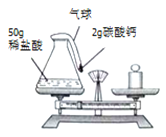
题目内容
【题目】氢气和氧气的混合气体共5 g,点燃,使它们充分反应后恢复到室温,生成4.5 g的水,关于原混合气体的说法中正确的是( )
①可能是2.5 g氢气和2.5 g氧气
②可能是1 g氢气和4 g氧气
③可能是0.5 g氢气和4.5 g氧气
④可能是0.5 g氢气和4 g氧气
A. 只有①正确 B. 只有②③正确
C. ①②③都正确 D. 只有④正确
【答案】B
【解析】根据氢气和氧气的混合气体共5 g,点燃,使它们充分反应后恢复到室温,生成4.5 g的水。⑴氧气剩余0.5g. ⑵氢气剩余0.5g.水中氢氧质量比是1:8.只有 ②可能是1 g氢气和4 g氧气。③可能是0.5 g氢气和4.5 g氧气。正确。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
【题目】实验室部分装置如图所示,请回答下列问题。

(1)选择发生和收集氧气的装置或药品,填写在下表中(填字母)。
选用药品 | 发生装置 | 收集装置 |
_______ | B | _______ |
高锰酸钾 | _______ |
(2)如果用二氧化锰与浓硫酸加热制备氧气,可选用的发生装置是_________ (填字母)。
(3)选用F装置收集气体时,下列实验操作正确的是_____________ (填序号)。
①反应前,将集气瓶注满水,用玻璃片盖住瓶口,倒立在盛水的水槽中
②开始反应后,等到气泡连续且均匀时,再将导管口移入集气瓶
③收集气体后,将集气瓶在水下盖上玻璃片再移出水槽
④实验结束时,先撤走酒精灯,然后将导管从水槽中取出
(4)用B装置制取氧气时,反应速率比较快,可能导致实验变得不安全,你准备采用的改进措施是___________________________________________________________。