题目内容
【题目】将质量相等的锌粉和铁粉,分别放入两个烧杯中,再分别倒入质量相等、浓度相同的稀硫酸充分反应,测得生成氢气的质量(m)随反应时间(t)变化的曲线如图所示。下列说法不正确的是
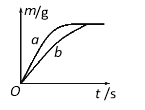
A.曲线b表示铁和稀硫酸的反应 B.反应后溶液的质量不相等
C.至少有一种金属剩余 D.放铁粉的烧杯中硫酸有剩余
【答案】D
【解析】
试题分析:金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au在金属活动顺序表中,排在氢前边 的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强,相同条件下反应越快,所以曲线b表示铁和稀硫酸的反应;生成氢气量相同时,反应的锌粉和铁粉质量不相等,所以反应后溶液的质量不相等;生成氢气的质量与相对原子质量成反比,即相对原子质量越大,生成氢气越少,因此,生成相同质量的氢气时,反应的锌比铁多,因此铁一定有剩余,锌可能有剩余;

练习册系列答案
相关题目