题目内容
【题目】下图为某化工生产流程图,下列有关说法正确的是
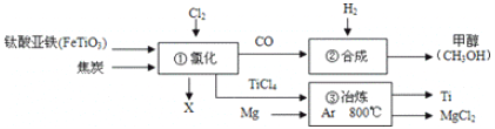
A. 钛酸亚铁(FeTiO3)中钛元素为+3价
B. ①中反应为:2FeTiO3+6C+7Cl2=2X+2TiCl4+6CO,则X为FeCl2
C. ②中为使原料全部转化为甲醇,理论上CO和H2投料的分子数比为1:2
D. ③中氩气(Ar)作保护气,反应类型为置换反应
【答案】CD
【解析】
A、铁元素显+2价,氧元素显-2价,设钛元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+x+(-2)×3=0,则x=+4价,故选项错误;
B、根据质量守恒定律,化学反应前后原子的种类和个数不变,反应前Fe:2,Ti:2,O:6,C:6,Cl:14;反应后Fe:0,Ti:2,O:6,C:6,Cl:8;则2X中含有2个铁原子、6个氯原子,则X的化学式为FeCl3,故选项错误;
C、一氧化碳和氢气反应生成甲醇的化学方程式为CO+2H2═CH3OH,理论上CO和H2投料的分子数比为1:2,故选项正确;
D、③中氩气(Ar)作保护气,则镁和TiCl4反应生成钛和氯化镁,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故选项正确。故选CD。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如下:

(1)操作1把废渣粉碎的目的 。
(2)在废渣粉末中加入NaCl和O2的目的是:CuS、NaCl和O2在高温条件下反应生成CuCl2和Na2SO4,写出该反应的化学方程式 。
(3)【查阅资料】:不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离。下表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
操作3的名称是 ,其中用到玻璃棒的作用是 。在此操作之前,为了使溶液中的Fe3+变成Fe(OH)3沉淀而除去,你认为调节溶液的pH到 (填数值范围)比较合适。
(4)流程图中能循环利用的物质是 和水。