题目内容
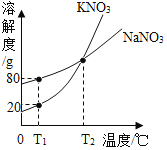
【题目】如图表示的是![]() 和
和![]() 的溶解度曲线。下列说法正确的是
的溶解度曲线。下列说法正确的是
A.![]() 时,
时,![]() 溶液中溶质和溶液的质量比为4:9
溶液中溶质和溶液的质量比为4:9
B.![]() 时,
时,![]() 和
和![]() 两种溶液的溶质质量分数相等
两种溶液的溶质质量分数相等
C.![]() 时,在50g水里加入15g
时,在50g水里加入15g![]() 固体,充分溶解,得到的溶液质量小于65g
固体,充分溶解,得到的溶液质量小于65g
D.若![]() 中混有少量
中混有少量![]() ,可用蒸发溶剂的方法提纯
,可用蒸发溶剂的方法提纯![]()
【答案】C
【解析】
A、T1℃时,硝酸钠的溶解度是80g,所以饱和NaNO3溶液中溶质和溶液的质量比为80g:180g=4:9,本题没有标明是饱和,故A错误;
B、T2℃时,NaNO3和KNO3两种物质的溶解度相等,但是溶液的状态不能确定,所以溶液的溶质质量分数不能确定,故B错误;
C、T1℃时,硝酸钾的溶解度是20g,所以在50g水里加入15gKNO3固体,充分溶解,得到的溶液质量是60g,小于65g,故C正确;
D、硝酸钾的溶解度受温度变化影响较大,所以KNO3中混有少量NaNO3,可用降温结晶的方法提纯KNO3,故D错误。
故选:C。

【题目】某兴趣小组在20℃时,向100g水中分别加入下列物质,测得溶解前后温度变化的最大值如下表,回答下列问题。(20℃时,氢氧化钠的溶解度为109g)
物质 | 氢氧化钠 | 氯化钠 | 硝酸铵 | |||
质量/g | 10 | 15 | 10 | 15 | 10 | 15 |
温度变化/℃ | 22.80 | 33.21 | -0.92 | -1.43 | -6.02 | -8.18 |
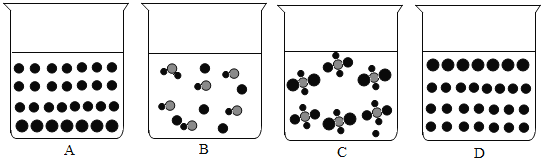
(1)如图示能反映氯化钠溶液的微观示意图的是______________(填字母序号![]() 表示钠离子,
表示钠离子,![]() 表示氯离子,
表示氯离子, ![]() 表示水分子)。
表示水分子)。
(2)写出氢氧化钠转化为氯化钠,且属于中和反应的化学方程式____________。
(3)为寻找一种溶于水后能起到降温作用制成冰袋的物质,选用上表中的__________ (填化学式)降温效果最好。
(4) 20℃时,15g 氢氧化钠溶于100g水后得到的溶液中溶质的质量分数是___________。某同学继续向其中加入100g氢氧化钠固体,观察到固体全部溶解,原因是_______________。
【题目】某化学兴趣小组在实验室做了如图所示的A、B两个实验。
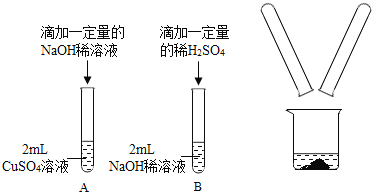
(1)B实验中发生反应的化学方程式为_____________________________________。
(2)A、B两个实验结束后,小组同学将两支试管中的废液同时倒入一洁净的烧杯中(如图所示),混合后,观察到烧杯中有蓝色沉淀.同学们将烧杯内的物质过滤,对所得滤液中溶质的成分进行探究.
(猜想)小明猜想:滤液中的溶质是Na2SO4、CuSO4;
小光猜想:滤液中的溶质是Na2SO4;
小英猜想:滤液中的溶质是Na2SO4、CuSO4、H2SO4;
你的猜想:滤液中的溶质还可能是_____________________。
(讨论)你认为_________的猜想一定不合理,理由是_______________。如果滤液为无色,还可排除_____的猜想。
(实验)若你的猜想正确,请完成下表的方案。
实验步骤 | 预期的实验现象 | 实验结论 |
取少量滤液于试管中,滴入_____ | ___________________ | 你的猜想正确 |