题目内容
【题目】从古至今,金属材料一直是生活和工业生产中应用极为普遍的一类物质。
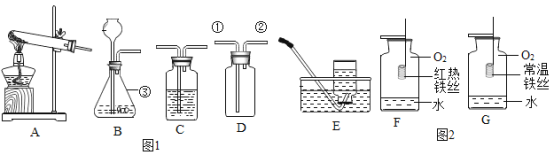
(1)日常生活中家里防盗铁网上常刷一层“银粉”漆,其实“银粉”就是金属铝粉,利用了铝的什么性质:_______。
(2)金属汞常用在体温计中,请从微观粒子的观点解释体温计测量体温时汞柱上升的现象:_______;若不慎将体温计打破,散落出来的汞产生的汞蒸气会对人体产生危害。此时,可撒一些硫粉在上面,硫与汞发生化合反应生成固体硫化汞,请写出其化学方程式____。
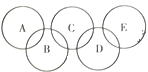
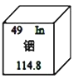
(3)磷化铟是用来制造光电子器件和微电子器件的新型材料,从如图中可知,铟原子在元素周期表中位于第_________周期,铟原子与 A、B、C、D 四种粒子中的化学性质最相似的是_________。
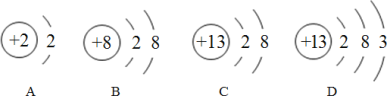
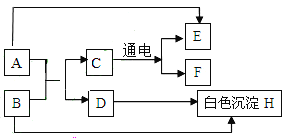
(4) 若将一定量的锌粉和铁粉加入到硫酸铜溶液中,待充分反应后过滤,再在滤渣中加入稀盐酸,有气泡产生。则滤渣中一定含有________(填物质名称),滤液中一定含有__________(填化学式)。
【答案】抗腐蚀性能好 温度升高,汞原子的间隔增大 Hg + S = HgS 五或5 D 铜、铁(写化学式不得分) ZnSO4(写名称不给分)
【解析】
(1)铝的化学性质较活泼,易与空气中的氧气发生反应,在铝的表面生成一层致密的氧化铝薄膜,保护好铝制品,所以把铝粉刷在铁的表面上是为了保护铁不易被腐蚀,利用了铝的抗腐蚀性能好。
(2)从微观粒子的观点分析,体温计测量体温时,由于温度升高,汞原子的间隔增大,汞柱上升;硫与汞发生化合反应生成固体硫化汞,化学方程式为Hg + S = HgS。
(3)从铟原子结构示意图可知,铟原子结构示意图有五个电子层,则铟原子在元素周期表中位于第五周期。原子的最外层电子数相同,化学性质相似,铟原子结构示意图的最外层电了数为3,故选D。
(4)将一定量的锌粉和铁粉加入到硫酸铜溶液中,由于锌和铁都比铜活泼,所以锌和铁都能与硫酸铜反应,反应顺序是锌先与硫酸铜反应,待锌反应完成,如果还有硫酸铜剩余,铁再与硫酸铜反应。待充分反应后过滤,再在滤渣中加入稀盐酸,有气泡产生。因为锌先参与反应,铁后参与反应,则滤渣中一定含有生成的铜和剩余的铁,可能含有锌;因为有铁,滤液中一定不含硫酸铜,一定含有生成的硫酸锌,可能有硫酸亚铁。

 优生乐园系列答案
优生乐园系列答案【题目】小林同学在体育课上腿部擦伤,医务室的大夫在她伤口上涂了医用过氧化氢溶液,小林看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?
(1)小林准备用如图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气,记录2分钟收集的气体体积。请写出过氧化氢分解的反应方程式:_____________。
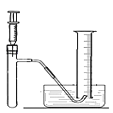
(2)小林查阅了相关资料,并进行了探究实验
(查阅资料)
①过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
②温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)
猜想1:过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(进行实验)
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 分两次进行实验,均注入5mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5mL | 。 |
② | 分两次进行实验 第一次将装有一小粒过氧化氢酶的试管浸在37℃的温水中,注入5mL过氧化氢溶液 第二次 | 第一次,量筒中2分钟收集到的气体体积为56 mL 第二次,量筒中2分钟收集到的气体体积为 | 过氧化氢分解加快是因为过氧化氢酶的作用 |
a.实验①结论是_____________ 。
b.实验②中横线部分应进行的操作是____________。
c.实验②中第二次收集到的氧气体积为__________。
(实验反思)
小林反思了实验过程,认为人体中过氧化氢酶是在体温条件下发挥作用的,实验得出的结论可能存在不足。因此又补充进行了几组实验,数据记录如下表所示。
d.通过这些数据,你能得出的新结论是______________。
加入过氧化氢酶 | 不加过氧化氢酶 | |||||
反应温度/℃ | 25 | 37 | 42 | 25 | 37 | 42 |
收集到气体体积/mL | 39 | 56 | 34 | 5 | 5 | 5 |