题目内容
【题目】化学兴趣小组探究金属与酸反应时,小珍同学将浓硫酸与铜粉混合加热,一段时间后,观察到溶液变蓝色,同时闻到刺激性气味。
[提出问题]铜能与浓硫酸反应,反应生成的刺激性气味的气体是什么?
[猜想与假设]猜想1:可能是二氧化硫
猜想2:可能是____________。
猜想3:可能是二氧化硫与三氧化硫
猜想4:可能是氯化氢气体
大家讨论后认为猜想4不合理,依据是_________。
[查阅资料]SO2和SO3分别与氢氧化钡溶液反应生成亚硫酸钡和硫酸钡白色沉淀。硫酸钡沉淀不溶于酸,亚硫酸钡沉淀可溶于稀盐酸,反应生成有刺激性气味的气体。
[实验探究]如图所示,小珍对浓硫酸与铜粉的混合物加热,将产生的气体通入饱和氢氧化钡溶液中,观察到装置B中________时,停止加热,用注射器向装置B中注入足量的稀盐酸,观察到的现象是_____________。
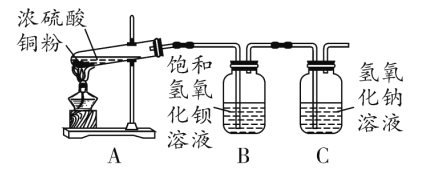
[实验结论]猜想1正确。
[反思拓展]
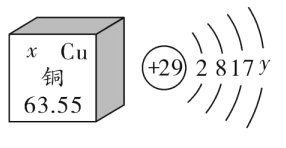
①铜与浓硫酸加热反应生成一种硫酸盐和两种氧化物,写出铜与浓硫酸反应的化学方程式____________。
②C装置的作用是_________。
③铜与稀硫酸加热不发生反应,铜与浓硫酸加热能发生反应,由此得出的结论是________(填序号)。
A 浓硫酸与稀硫酸的化学性质不同
B 浓硫酸与铜反应只利用了浓硫酸的酸性
C 铜能与浓硫酸反应证明铜的金属活动性排在氢前面
【答案】三氧化硫 质量守恒定律( 或反应物中没有氯元素,不可能生成氯化氢) 有白色沉淀生成 沉淀全部溶解 ![]() 吸收尾气,防止污染空气 A
吸收尾气,防止污染空气 A
【解析】
[猜想与假设]根据给出的几种猜想及质量守恒定律(反应前后元素的种类不变)可知猜想2可能是三氧化硫;依据质量守恒定律,反应物中没有氯元素,无法生成氯化氢,故猜想4不合理;
[实验探究]由实验结论“猜想1正确”可知,生成的有刺激性气味的气体只有SO2,SO2与氢氧化钡溶液反应生成亚硫酸钡白色沉淀,亚硫酸钡沉淀溶于稀盐酸且反应生成有刺激性气味的气体,则将浓硫酸与铜粉混合加热产生的气体通入饱和氢氧化钡溶液中,观察到有白色沉淀生成时,停止加热后,用注射器向装置B中注入足量的稀盐酸,观察到有气泡产生,沉淀全部溶解;
[反思拓展]①铜与浓硫酸加热反应生成一种硫酸盐和两种氧化物,根据质量守恒定律可知,硫酸盐为硫酸铜,氧化物为二氧化硫和水,反应的化学方程式为:![]() ;
;
②二氧化硫有毒,排放到空气中会造成污染,C装置的作用是吸收反应产生的二氧化硫;
③铜与稀硫酸,加热不发生反应,铜与浓硫酸加热能发生反应,由此得出的结论是浓硫酸与稀硫酸的化学性质不同,故选A。