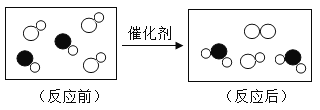
题目内容
【题目】下图为实验室制取某些气体的装置示意图,据此回答有关问题。
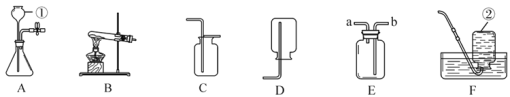
(1)分别写出图中序号①、②的仪器名称:_______、_______。
(2)实验室用A装置制取氧气时,仪器①中装入的药品是________;有人用F装置收集到的氧气不纯的原因可能是________;若选用E装置收集氧气,气体应从_____(填“a”或“b”)端进入。
(3)实验室用A装置制取氧气后,为了回收二氧化锰应将该混合物先过滤,再_______(填操作名称),从而得到干燥纯净的二氧化锰。
(4)实验室用B装置制取氧气时,B中装入的紫黑色固体是 ____(填写物质的化学式)。
(5)通常状况下,甲烷是一种无色无味气体,难溶于水,密度比空气小。实验室常用醋酸钠和碱石灰两种固体混合加热制得,制取并收集甲烷可选用的装置是______ (填字母序号)。
【答案】长颈漏斗 集气瓶 过氧化氢溶液(或“双氧水”) 导管口刚有气泡冒出时就开始收集气体(或“原集气瓶中空气未被水排尽”,或“收集前,集气瓶内有气泡”) b 干燥(或“烘干”) KMnO4 BD(或BE或BF,填其中之一都正确)
【解析】
(1)仪器①的名称是长颈漏斗,故填长颈漏斗;
仪器②的名称是集气瓶,故填集气瓶。
(2)用A装置制取氧气时用到的药品是过氧化氢溶液和二氧化锰,仪器①中装入的药品是过氧化氢溶液(或“双氧水”),故填过氧化氢溶液(或“双氧水”);
用F装置收集到的氧气不纯的原因可能是导管口刚有气泡冒出时就开始收集气体,或原集气瓶中空气未被水排尽,或收集前,集气瓶内有气泡,故填导管口刚有气泡冒出时就开始收集气体(或“原集气瓶中空气未被水排尽”,或“收集前,集气瓶内有气泡”);
氧气的密度大于空气的密度,用E 装置收集氧气时,氧气应从长管进入瓶中,故填b。
(3)过滤后得到的二氧化锰表面有些水分,要通过干燥或烘干处理掉,故填干燥(或“烘干”)。
(4)用B装置制取氧气时需用固体药品,用到的紫黑色固体药品是高锰酸钾,其化学式为KMnO4,故填KMnO4。
(5)用醋酸钠和碱石灰两种固体混合加热制得甲烷,发生装置应选固体受热发生装置;甲烷难溶于水,密度比空气小,收集甲烷可选用排水法,或向上排空气法,故填BD(或BE或BF,填其中之一都正确)。

【题目】FeCl3(氯化铁)溶液也能对过氧化氢的分解能起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响。
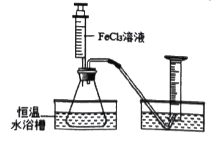
Ⅰ.分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,通过观察______,就可以粗略判断,得到实验结果,为进一步判断上述试验结论的准确性,运用图示装置,小刚同学进行了如下实验方案设计进行定量研究。
Ⅱ.[方案一]在不同过氧化氢浓度下,测定收集相同体积气体所需的时间。
[方案二]在不同过氧化氢浓度下,测定_________。
方案二的实验测量结果:
物理量 序号 | H2O2溶液的浓度和体积 | 2% FeCl3溶液的 体积(mL) | 反应的时间 ( min) | 生成O2的体积 (mL) |
1 | 30%,10mL | x | 5 | V1 |
2 | 10%,10mL | 3 | y | V2 |
(1)表中x=_________,y=_______。
(2)通过测量,若V1_______V2(填“>”、“=”或“<”) 得出的实验结论为_____。
【题目】某研究学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品20g,把80g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的二氧化硅等杂志不溶于水,不与稀盐酸反应)。根据实验数据计算:
实验次数 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
1 | 20 | 15 |
2 | 20 | 10 |
3 | 20 | 6.8 |
4 | 20 | 6.8 |
(1)样品中碳酸钙的质量分数是______。
(2)计算样品中碳酸钙完全反应时生成的二氧化碳的质量_____。
【题目】鸡蛋主要由蛋壳、蛋壳膜、蛋白、蛋黄等几个部分组成,其中蛋壳的主要成分是CaCO3,里面覆盖一层蛋壳膜。我校兴趣小组的同学为此开展了以下探究活动:
【提出问题1】鸡蛋白中主要的营养成分是______ ;
【查阅资料】
a、CaCO3灼烧分解生成氧化钙和一种无毒的氧化物。
b、蛋壳中的其它成分不参加反应。
c、NaHCO3+HCl= NaCl + H2O +CO2↑,Ba(OH)2+CO2=BaCO3↓+H2O,
d、已知仪器a装有10%的稀盐酸,其他成分均不与HCl反应,装置内试剂均足量。
【提出问题2】蛋壳中的CaCO3含量是多少呢?小华拟将该蛋壳放在空气中充分灼烧完成测定;小明拟通过蛋壳与稀盐酸反应完成测定。请你参与他们的探究。
【设计方案】他们分别称取12.0g蛋壳设计了以下不同的实验方案:
小华的方案:
称取12.0g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16g。则:减少的质量是______ (填化学式)的质量,经计算得蛋壳中的CaCO3的质量分数为______ 。
(3)小明的方案:小明设计了如下图所示的实验装置。
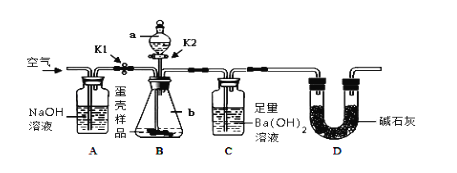
【实验步骤】
①按上图连接好装置后,并______ ;
②向B装置中加入蛋壳样品后,先通入空气一会儿;
③接下来的实验操作是______ ,直到______ 为止(填实验现象);
④再通入空气一会儿,至装置C中不再产生沉淀为止;
⑤将装置C中的固液混合物过滤、洗涤、烘干后称量其质量;
⑥重复上述实验。
【实验数据】重复实验,3次数据记录如下:
实验次数 | 实验1 | 实验2 | 实验3 |
装置C中沉淀质量(g) | 19.68 | 19.75 | 19.67 |
【实验分析及数据处理】
①上述数据能否用托盘天平称量______ 。(填“能”或“不能”)
②若无A装置,直接通入空气,则测定结果将______ 。(填“偏大”、“偏小”或“不变”)D装置的作用是___
③实验重复3次的目的是______ 。
④请利用3次实验数据的平均值,计算该蛋壳中的CaCO3质量分数______ 。
【实验反思】
下列各项措施中,能提高小明测定准确度的是______ (填序号)。
Ⅰ.在装置A、B之间增加盛有浓硫酸的洗气瓶
Ⅱ.缓缓滴加稀盐酸
Ⅲ.在装置B、C之间增加盛有饱和NaHCO3的洗气瓶
IV.直接称量装置C反应前后的质量