题目内容
100克质量分数为40%的氢氧化钠溶液恰好可以中和溶质质量分数为10%的稀盐酸,试计算需要的稀盐酸的质量.(化学方程式:NaOH+HCl═NaCl+H2O)
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:根据氢氧化钠的质量结合反应的化学方程式,可以计算需要的稀盐酸的质量.
解答:解:设需要的稀盐酸的质量为x,
NaOH+HCl═NaCl+H2O,
40 36.5
100g×40% x×10%
=
x=365g
答:需要的稀盐酸的质量是365g.
NaOH+HCl═NaCl+H2O,
40 36.5
100g×40% x×10%
| 40 |
| 100g×40% |
| 36.5 |
| x×10% |
x=365g
答:需要的稀盐酸的质量是365g.
点评:本题主要考查学生运用化学方程式进行计算的能力,比较简单,计算时要注意规范性和准确性.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
下列物质不属于盐的是( )
| A、苛性钠 NaOH |
| B、高锰酸钾KMnO4 |
| C、硝酸钠 NaNO3 |
| D、大理石CaCO3 |
下列物质的用途中,与其化学性质有关的是( )
| A、坚硬的金刚石用于切割玻璃 |
| B、镁粉用于照明弹 |
| C、氢气用于充灌气球 |
| D、活性炭做吸附剂 |
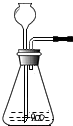 如图在制取气体的实验中,所添加的液体药品的量要
如图在制取气体的实验中,所添加的液体药品的量要
 如图所示:
如图所示: