题目内容
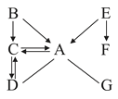
【题目】某白色固体甲的主要成分为NaCl,可能含有MgCl2、KCl、BaCl2和NaOH中的一种或几种杂质,为检验白色固体甲的成分并除去其中杂质,进行如下实验:
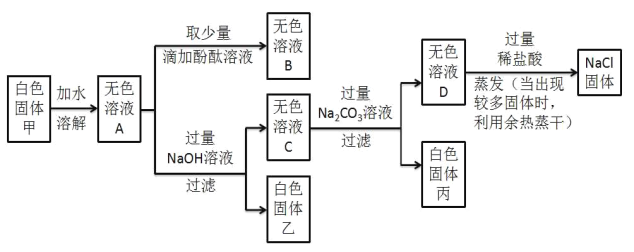
(1)写出生成白色固体丙的化学方程式______;
(2)向无色溶液D中加入过量稀盐酸的目的是_____;
(3)分析上述实验可知,白色固体甲中一定没有的物质是_____;
【答案】![]() 消耗未反应的碳酸钠 氢氧化钠、氯化钾
消耗未反应的碳酸钠 氢氧化钠、氯化钾
【解析】
白色固体甲加水溶解后,得无色溶液A,滴加酚酞得无色溶液B,说明固体中一定不含氢氧化钠;加入过量氢氧化钠得白色沉淀,说明有氯化镁,沉淀是氢氧化镁;加入过量碳酸钠溶液,得白色沉淀,说明有氯化钡,沉淀是碳酸钡,据此分析解决问题。
(1)白色固体丙是碳酸钡,是氯化钡和碳酸钠反应得到,化学方程式为![]() ;故填:
;故填:![]() 。
。
(2)无色溶液D最后得到氯化钠固体,加入过量稀盐酸的目的是消耗未反应的碳酸钠;故填:消耗未反应的碳酸钠。
(3)分析上述实验可知,一定存在氯化镁和氯化钡,一定不存在氢氧化钠和氯化钾;故填:氢氧化钠、氯化钾。

【题目】兴趣小组同学为了测定某中碳酸钙的质量分数,称取25.0g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次数 | 第1次 | 第2次 | 第3次 | 第4次 |
剩余固体质量(g) | 21.6 | 19.2 | 16.2 | 16.2 |
试计算:
(1)完全反应后生成二氧化碳的质量是__g。
(2)求珍珠粉中碳酸钙的质量分数。(写出计算过程)__________.
【题目】为探究催化剂对双氧水(H2O2)分解的催化效果,某研究小组做了如下实验:
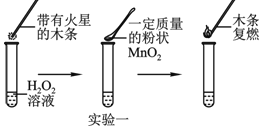
实验一:图中的实验能否证明MnO2是双氧水分解反应的催化剂?并说明理由______。
数据记录表
1%H2O2溶液(mL) | 50 | 50 | 50 |
加入MnO2的质量(g) | 0.1 | 0.2 | 0.4 |
测量40秒末得到O2体积(mL) |
实验二:从上面表格的设计可以看出,该实验的目的是______。
实验三:学习了催化剂知识后,某化学探究小组开始了“寻找新的催化剂”研究性实验:
(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
(实验探究)
实验步骤 | 实验现象 |
I.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag. | |
IV分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 |
(实验结论)
(1)A中产生的气体是______;
(2)实验II.III证明:氧化铁的______和______在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的文字表达式______。
(实验评价)
(4)实验设计IV的目的是______;
(5)若实验IV观察到D试管中产生气泡的速率更快,由此你可以得到的结论是:______。