题目内容
【题目】有一工业过程:
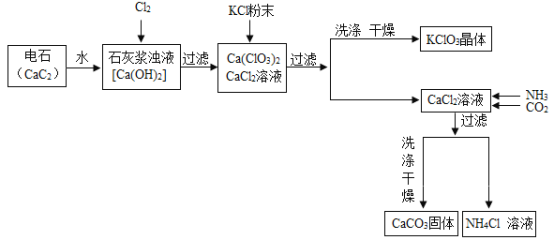
按要求回答下列问题:
(1)请将电石与水反应的化学方程式补充完整:CaC2+2H2O=Ca(OH)2+_____↑,该反应非常剧烈,操作中要注意控制(____)
A 电石的量 B 滴加水的速度 C 温度
(2)有关物质常温下的溶解度如下:
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
溶解度/g | 29.0 | 74.5 | 7.3 | 34.2 |
上述流程中加入KCl粉末,KCl与_____(填化学式)发生复分解反应得到KClO3晶体,该过程得到KClO3晶体的原因是_____。为了提高KClO3晶体的产率,选择以下_____作为洗涤剂(填字母序号)。
a.水 b.饱和氯酸钾溶液 c.饱和氯化钾溶液
(3)写出上述流程中,向CaCl2溶液中通入两种气体生成CaCO3的化学方程式_____。
【答案】C2H2 B Ca(ClO3)2 常温下,KClO3的溶解度最小,先析出 b CaCl2+CO2+2NH3+H2O=2NH4Cl+CaCO3↓
【解析】
(1)根据质量守恒定律,化学反应前后原子的种数和数目不变判断另一种生成物是C2H2,该反应非常剧烈,操作中要注意控制滴加水的速度来控制反应的速度,故选B;
(2)由图中反应流程氯化钾加入到氯化钙和氯酸钙混合物中发生反应,根据复分解反应发生的条件,氯化钙与氯化钾不能生成沉淀或气体或水,故不反应,故氯化钾只能与氯酸钙反应生成氯酸钾和氯化钙;由题中物质在常温下的溶解度表中数据发现常温下氯酸钾溶解度较小,所以过量的氯酸钾会结晶析出;为了提高KClO3晶体的产率,应选择饱和氯酸钾溶液作为洗涤剂,故选b;
(3)由题中信息判断反应物是NH3、CO2和CaCl2溶液,生成物是CaCO3固体和NH4Cl溶液,反应的化学方程式为:H2O+2NH3+CO2+CaCl2=CaCO3↓+2NH4Cl。

 小学教材完全解读系列答案
小学教材完全解读系列答案