题目内容
【题目】请结合下图回答问题:
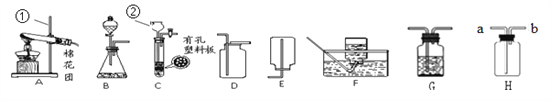
(1)写出图中有标号仪器的名称:①__________,② ___________。
(2)用加热高锰酸钾的方法制取氧气,应选用的发生装置是(填字母编号)_______,装入药品前应先_______,写出该反应化学方程式_____________________。
(3)用B、D装置组合制取二氧化碳气体的化学方程式___________________________。 若要获得干燥的该气体,除发生、收集装置外,还应选用G装置,并在该装置中盛放_______(填名称)。如果用H装置收集该气体,则气体从_______________端进入(填“a”或“b”)。
(4)实验室用锌粒和稀硫酸反应制取H2的化学方程式___________________,常选用装置B或C, C与B相比较,C的优点是_______________________________________
【答案】 铁架台 长颈漏斗 A 检查装置的气密性 2KMnO4![]() K2MnO4+MnO2+O2↑ CaCO3+2HCl=CaCl2+CO2↑+H2O 浓硫酸 a Zn + H2SO4=ZnSO4 + H2↑ 控制反应的发生与停止
K2MnO4+MnO2+O2↑ CaCO3+2HCl=CaCl2+CO2↑+H2O 浓硫酸 a Zn + H2SO4=ZnSO4 + H2↑ 控制反应的发生与停止
【解析】(1)根据常见仪器解答;(2)根据反应物的状态、反应条件解答;根据装入药品前应先检查装置的气密性解答;根据高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气解答;(3)根据碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳解答;根据浓硫酸有吸水性解答;根据二氧化碳的密度比空气大,应“长进短出”解答;(4)根据锌与稀硫酸反应生成硫酸锌和氢气解答;根据C装置能控制反应的发生与停止解答。(1)图中有标号仪器的名称:①铁架台,②长颈漏斗;(2)高锰酸钾是固体,反应需要加热,故应选择固体加热型发生装置A;装入药品前应先检查装置的气密性;高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为2KMnO4△K2MnO4+MnO2+O2↑;(3)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;若要获得干燥的该气体,除发生、收集装置外,还应选用G装置,并在该装置中盛放浓硫酸。如果用H装置收集该气体,则气体从a端进入;(4)锌与稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑;装置C与B相比较,C的优点是能控制反应的发生与停止。

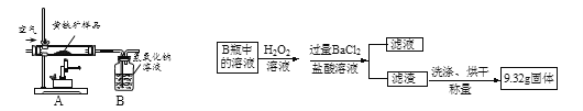
【题目】向100gBaC12溶液中滴加CuSO4溶液至完全反应,反应过程中生成沉淀的质量与滴加CuSO4溶液的质量关系如下表所示(硫酸钡不溶于水),请计算:
滴加CuSO4溶液的质量/g | 10 | 20 | 30 | 40 |
生成硫酸钡的质量/g | 2.33 | 4.66 | 6.99 | 6.99 |
(1) 恰好完全反应时生成硫酸钡的质量为________g;
(2) BaC12溶液中溶质的质量分数为________(写出计算过程)。
【题目】鸡蛋主要由蛋壳、蛋壳膜、蛋白、蛋黄等几个部分组成,其中蛋壳的主要成分是CaCO3,里面覆盖一层蛋壳膜。化学活动兴趣小组的同学开展了以下探究活动:
【提出问题】蛋壳中的CaCO3含量是多少?

【查阅资料】
a、蛋壳经过科学检测其中含CaCO3的质量分数约为82%~85%,含蛋白质质量分数约14-17%。
b、蛋壳膜中蛋白质含量约为90%~93%。
c、Ba(OH)2是一种碱,化学性质与Ca(OH)2相似。
【设计方案】
方案一:用“灼烧法”,将该蛋壳放在空气中充分灼烧并采集相关数据进行测定。
方案二:用“酸处理法”,将蛋壳与稀盐酸反应后再进行吸收转变为碳酸钡进行测量处理。
【进行实验】
方案一:称取12.0 g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16 g。
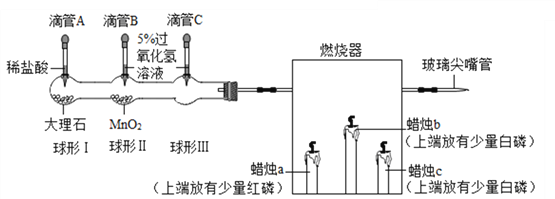
方案二:用下图所示的连接实验装置,称取12 g蛋壳样品进行实验(假设其他成分均不与HCl反应,装置内试剂均足量。)
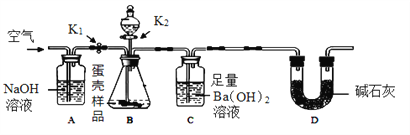
【实验步骤】
① 按上图连接好装置后,并检查装置的气密性;
② 向B装置中加入蛋壳样品后,先通入一会儿空气;
③ 关闭K1,打开K2,向蛋壳样品中滴入10%的盐酸,直到__________为止;
④ 关闭K2,打开K1,再缓缓通入空气一会儿,至装置C中不再产生沉淀为止;
⑤ 将装置C中的固液混合物进行过滤、__________、烘干后称量其质量;
⑥ 重复上述实验。
【数据处理】
方案一:产生的CO2质量__________g,蛋壳中的CaCO3的质量分数为__________%。(保留一位小数)
方案二:重复3次实验,记录数据如下:
实验次数 | 第1次 | 第2次 | 第3次 |
装置C中沉淀质量(/g) | 19.68 | 19.75 | 19.67 |
方案二:实验测得蛋壳中的CaCO3的质量分数__________(写出计算过程,)
(已知:Mr(CaCO3):100 Mr(BaCO3):197)
【评价反思】
(1)方案二中装置D的作用是__________。
(2)方案一测定值与科学检测的数据有较大误差,主要原因是__________。
【题目】如图是实验室制取气体的常用装置,请根据图回答下列问题。
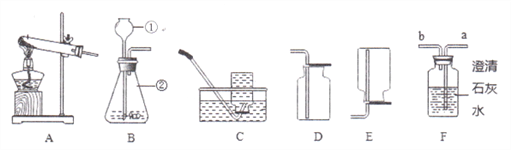
(1)写出图中标有序号的仪器名称:①________;②________。
(2)①将高锰酸钾和棉花装入装置A的试管中制取氧气,其化学方程式是______;
②为收集较为纯净的氧气,应选择装置______。(填字母)
(3)某广口瓶上的标签已破损,只剩下“苏打”两个字,某兴趣小组将适量药品装入装置B中,添加稀盐酸,根据装置F中的现象________(请填写实验现象),可确定该气体为CO2,但仍无法确定广口瓶中盛放的药品是苏打,理由是_________(用化学方程式表示)。
(4)为进一步探究该药品的成分(假设药品无其他成分),兴趣小组在室温时,分别向盛有碳酸氢钠、碳酸钠和该药品的锥形瓶中注入等体积、足量的10%稀盐酸,记录如表:
实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
名称 | 质量/g | ||
① | 碳酸氢钠 | 1 | V1 |
② | 碳酸钠 | 1 | V2 |
③ | 药品 | X | V3 |
表中x=______;V1______V2=V3(填“>”、“<”或“=”),因此可确定广口瓶盛放的药品是“苏打”碳酸钠。