题目内容
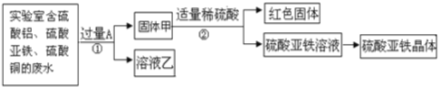
【题目】某白色固体甲,可能含有硫酸钠、氢氧化钠、碳酸钠、氯化钠中的一种或几种;某无色溶液乙是初中化学常见的一种可溶性钡盐溶液。为探究它们的成分,进行如下实验。对于固体甲的分析正确的是
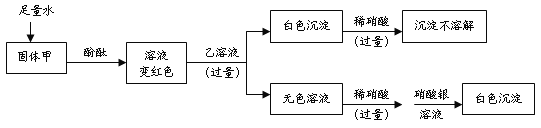
A.不一定有硫酸钠 B.一定有氢氧化钠
C.一定有氯化钠 D.至少含有碳酸钠、氢氧化钠中的一种
【答案】B
【解析】
试题分析:这是一道实验型的推断题,解答时应紧紧抓住实验过程中出现的现象来进行判断,固体甲溶解后,加入酚酞溶液变为红色,说明溶液呈碱性,故可能含有氢氧化钠或碳酸钠或两者的混合物,继续加入一种可溶性钡盐溶液,得白色沉淀,这白色沉淀可能是硫酸钡或碳酸钡或两者的混合物,但接着在白色沉淀中加入稀硝酸,沉淀不溶解,说明白色沉淀中不含有碳酸钡,只有硫酸钡,从而可以证明原固体甲中一定含硫酸钠和氢氧化钠,一定不含碳酸钠,后来在无色溶液中加入硝酸银,得到了不溶于稀硝酸的白色沉淀氯化银,说明溶液中含有氯离子,但并不能就此说明原固体甲中含氯化钠,因为氯离子可能是可溶性钡盐中带入的,故选B

练习册系列答案
相关题目
【题目】除去下列物质中的少量杂质,所选用试剂及操作方法均正确的是( )
选项 | 物质(括号内为杂质) | 选用试剂 | 操作方法 |
A | CO2(CO) | 过量O2 | 点燃 |
B | CaO(CaCO3) | 足量蒸馏水 | 过滤、蒸发 |
C | Ca(OH)2溶液中的(NaOH) | 足量CuCl2溶液 | 过滤 |
D | FeCl2溶液(CuCl2溶液) | 足量铁粉 | 过滤 |