题目内容
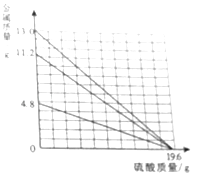
【题目】如图是a、b、c三种固体物质的溶解度曲线,请回答下列问题: 
(1)℃时,a、c两物质的溶解度相等.
(2)在t2°C时,a、b、c三种饱和溶液降温至t1°C时溶质的质量分数由大到小的顺序是 .
(3)在t2°C是,将150克a的饱和溶液稀释成质量分数为20%的溶液需加水克.
【答案】
(1)t1
(2)b>a>c
(3)100
【解析】解:(1)t1℃时,a、c两物质的溶解度相等,所以答案是:t1;(2)在t2°C时,a、b、c三种饱和溶液降温至t1°C时溶质的质量分数由大到小的顺序是b>a>c,因为a析出固体比较多,c变为不饱和溶液;所以答案是:b>a>c;(3)在t2°C是,a的溶解度是50g,因此a的质量分数= ![]() ,设将150克a的饱和溶液稀释成质量分数为20%的溶液需加水的质量为x,
,设将150克a的饱和溶液稀释成质量分数为20%的溶液需加水的质量为x, ![]() ,x=100g,所以答案是:100;
,x=100g,所以答案是:100;
【考点精析】解答此题的关键在于理解固体溶解度曲线及其作用的相关知识,掌握1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和),以及对溶质的质量分数、溶解性和溶解度的关系的理解,了解溶质质量分数 =溶质质量/溶液质量*100% ;溶解度=溶质质量/溶剂质量*100g (必须选取饱和溶液);溶液质量=溶质质量(克)+溶剂质量(克) ;对于饱和溶液,溶液质量分数w = S/(S+100);所以溶解度S = 100/(1/w-1).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验目的、操作、现象、结论都正确的是( )
选项 | 实验目的 | 实验操作 | 实验现象 | 实验结论 |
A | 测定溶液pH | 用玻璃棒蘸取待测液滴在用蒸馏水润湿的pH试纸上 | 试纸变为浅红色 | 溶液pH为2 |
B | 鉴别NaOH和NH4NO3 | 在装有等量水的试管中分别加入a、b固体 | 加a的试管水温升高,加b的试管水温降低 | A是NaOH,b是NH4NO3 |
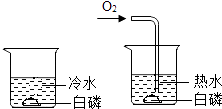
C | 验证燃烧是否需要O2 | 做白磷是否燃烧的对比实验 | 前者不燃烧,后者燃烧 | 燃烧需要O2 |
D | 比较Al、Cu的活泼性 | 将未经打磨的Al条放入CuSO4溶液中 | 无明显现象 | Al的活性炭低于Cu |
A.A
B.B
C.C
D.D
【题目】为测定某BaCl2溶液的溶质质量分数,进行如下实验:取208g该溶液与烧杯中,加入2g稀硝酸溶液酸化,无任何现象.然后将60g一定溶质质量分数的硫酸溶液分三次加入,每次充分反应后过滤、称量(实验中物质的质量损失忽略不计).数据如表:
第1次 | 第2次 | 第3次 | |
加入硫酸溶液的质量/g | 20 | 20 | 20 |
过滤后溶液的质量/g | 210 | 210 | 223.4 |
根据以上数据计算:(BaCl2+H2SO4═BaSO4↓+2HCl)
(1)该实验过程中产生沉淀的总质量为g.
(2)该BaCl2溶液总溶质的质量分数为多少?