题目内容
【题目】在相同质量、相同质量分数的稀硫酸中,分别加入足量的Mg、Fe、Zn三种金属,其发生反应的质量关系如图所示,读识如图并判断,下面推理合理的是( ) ①反应速率:Mg>Fe>Zn
②反应生成氢气质量:Mg=Fe=Zn
③反应后溶液质量:Mg=Fe=Zn
④反应后溶液溶质质量分数:Mg<Fe<Zn.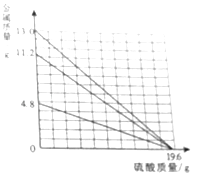
A.①②
B.③④
C.①③
D.②④
【答案】D
【解析】解:镁、锌、铁和硫酸反应的化学方程式为:
Mg+ | H2SO4= | H2↑ |
24 | 98 | 2 |
4.8g | 0.4g |
反应后溶质为:19.6g+4.8g﹣0.4g=24g
溶质质量分数为: ![]() ×100%
×100%
Zn+ | H2SO4=ZnSO4+ | H2↑ |
65 | 98 | 2 |
13g | 0.4g |
反应后溶质为:19.6+13g﹣0.4g=32.2g
溶质质量分数为: ![]() ×100%
×100%
Fe+H2SO4=FeSO4+ | H2↑ |
56 | 2 |
11.2g | 0.4g |
反应后溶质为:19.6g+11.2g﹣0.4g=30.4g
溶质质量分数为: ![]() ×100%①三种金属的活动性顺序为:Mg>Zn>Fe,所以反应速率:Mg>Zn>Fe,故错误;②依据化学方程式可知,反应生成氢气质量:Mg=Fe=Zn,故正确;③通过推导可知,硫酸中的溶剂质量相等,反应后溶液质量:Mg<Fe<Zn,故错误;④通过计算比较可知,反应后溶液溶质质量分数:Mg<Fe<Zn,故正确.
×100%①三种金属的活动性顺序为:Mg>Zn>Fe,所以反应速率:Mg>Zn>Fe,故错误;②依据化学方程式可知,反应生成氢气质量:Mg=Fe=Zn,故正确;③通过推导可知,硫酸中的溶剂质量相等,反应后溶液质量:Mg<Fe<Zn,故错误;④通过计算比较可知,反应后溶液溶质质量分数:Mg<Fe<Zn,故正确.
故选:D.
【考点精析】解答此题的关键在于理解金属材料的选择依据的相关知识,掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属.

练习册系列答案
相关题目