题目内容
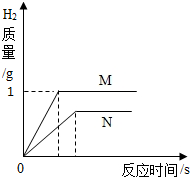
 相同质量的M、N两种活泼金属,分别于50g质量分数为8%的盐酸反应(M、N在生成物中均为+2价),反应关系如图.下列叙述一定正确的是( )
相同质量的M、N两种活泼金属,分别于50g质量分数为8%的盐酸反应(M、N在生成物中均为+2价),反应关系如图.下列叙述一定正确的是( )分析:观察金属和酸溶液反应的图象,进行分析可以得出:①得到的氢气的多少②消耗等质量金属时生成的氢气量的多少.据此分析解答即可;
解答:解:A、金属的活泼性强弱能用反应的速度体现,反应速度快则金属活动性越强,而此图象不能反映金属与盐酸反应的速度(没有反应时间的关系),故此图象不能证明金属的活泼性M>N.
B、相同质量的金属完全反应时,生成氢气较多的金属相对原子质量越小,由图象可知同质量的金属反应时M生成的氢气较多,但最终两者生成的氢气相等,则可说明M一定有剩余.
C、相同质量的金属(化合价相等)完全反应时,生成氢气较多的金属相对原子质量越小,由图象可知同质量的金属反应时M生成的氢气较多,所以相对原子质量M<N.
D、由以上分析可知等质量的两种金属完全反应是生成的氢气质量不等,而图象表明两者最终生成的氢气质量相等,所以消耗的盐酸一定相等且没有剩余.
故选B.
B、相同质量的金属完全反应时,生成氢气较多的金属相对原子质量越小,由图象可知同质量的金属反应时M生成的氢气较多,但最终两者生成的氢气相等,则可说明M一定有剩余.
C、相同质量的金属(化合价相等)完全反应时,生成氢气较多的金属相对原子质量越小,由图象可知同质量的金属反应时M生成的氢气较多,所以相对原子质量M<N.
D、由以上分析可知等质量的两种金属完全反应是生成的氢气质量不等,而图象表明两者最终生成的氢气质量相等,所以消耗的盐酸一定相等且没有剩余.
故选B.
点评:此题综合性较强,不仅需要根据图象和题意分析出直接信息,还需要学会分析图象的方法,一般看图象的转折点和图象的走势;

练习册系列答案
相关题目

 11、如图中M、N分别表示两种固体物质(不含结晶水)的溶解度曲线,试根据图中曲线判断下列说法正确的是( )
11、如图中M、N分别表示两种固体物质(不含结晶水)的溶解度曲线,试根据图中曲线判断下列说法正确的是( ) 相同质量的M、N两种活泼金属.分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如图.下列叙述正确的是( )
相同质量的M、N两种活泼金属.分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如图.下列叙述正确的是( )