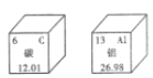
题目内容
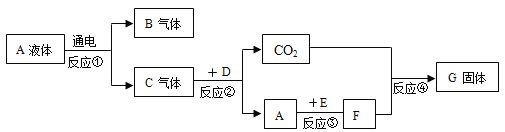
【题目】取少量氢氧化钠溶液于 A 试管中,完成如图实验,回答下列问题.
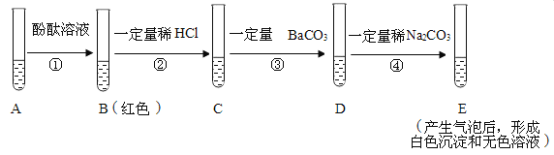
(1)步骤②发生的反应方程式____________;
(2)步骤③加 BaCO3 产生的现象有___________;
(3)最后将 E试管中混合物过滤,得到的滤液中溶质有哪几种情况?________________.
【答案】NaOH+HCl=NaCl+H2O 固体溶解,有气泡产生 NaCl和BaCl2;NaCl和Na2CO3;NaCl
【解析】
(1)步骤②氢氧化钠和稀盐酸反应会生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O,故填:NaOH+HCl=NaCl+H2O;
(2)步骤④中加碳酸钠产生气泡说明之前稀盐酸过量,故步骤③加 BaCO3稀盐酸会和碳酸钡发生反应生成氯化钡二氧化碳和水,现象为固体溶解有气泡产生,故填:固体溶解,有气泡产生;
(3)由E现象可知之前稀盐酸过量,步骤②氢氧化钠和稀盐酸生成氯化钠,步骤③碳酸钡和稀盐酸反应生成氯化钡,故D中溶质为氯化钠、氯化钡和氯化氢,E中现象刚开始产生气泡,后来形成沉淀是因为碳酸钠刚开始和氯化氢反应,反应完了之后再和氯化钡反应引起的,E中一定会有氯化钠,因为氯化钠没发生反应,一定没有氯化氢,氯化氢和碳酸钠反应掉了,碳酸钠、氯化钡可能有一种剩余,也可能都没有剩余,故溶质情况:NaCl和BaCl2;NaCl和Na2CO3;NaCl故填:NaCl和BaCl2;NaCl和Na2CO3;NaCl。

【题目】马英同学取某地石灰石样品12 g进行测定实验,现将100 g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示。试求:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 1.1 | 2.2 | m | 4.4 | 4.4 |
(1)m的值为_____g。
(2)12 g石灰石样品中碳酸钙的质量为____g。
(3)反应完全后最终溶液中氯化钙的质量分数?(写出计算过程,计算结果精确至0.1%)________