题目内容
【题目】元素周期表是学习化学的重要工具,如表是元素周期表的一部分.
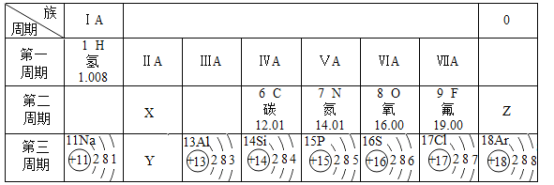
(1)15号元素方框内的数字是___;16号元素的离子符号是___.
(2)图中14.01表示氮元素的___;硅元素的原子核内质子数为___.
(3)通过分析,同一横行或同一纵行元素之间有一定的等量关系,例如:①同一纵行,各元素原子的最外层电子数相等;②同一横行,周期数等于各元素原子的___数.已知X、Y、Z代表三种不同种元素原子,下列有关说法不正确的是___(填序号).
①X和Z元素原子核外均有2个电子层;②Y离子的最外层电子数为10;③X和Y原子的化学性质相似;④Z原子的最外层电子数达到相对稳定结构.
【答案】5 S2﹣ 相对原子质量 14 电子层 ②
【解析】
(1)在原子中,质子数=核外电子数,所以磷原子的最外层电子数为:15﹣2﹣8=5;16号元素是硫原子,硫原子最外层有6个电子,在化学反应中易得到2个电子而形成单位负电荷的硫离子S2﹣;
(2)14.01表示氮元素的相对原子质量,硅元素的原子序数为14,则其原子核内质子数为14;
(3)同一横行,周期数等于各元素原子的核外电子层数;
①X和Z元素均位于第二周期,故原子核外均有2个电子层,故正确;
②Y是镁元素,镁原子核外有12个电子,核外电子排布为2、8、2结构,在化学反应中易失去最外层的2个电子,次外层变成最外层达到稳定结构,镁离子最外层有8个电子,故错误;
③X和Y原子的位于同一族,最外层电子数相同,所以化学性质相似,故正确;
④Z是氖元素,其原子的最外层电子数为8,达到相对稳定结构,故正确。

【题目】同学们在学碱的化学性质时,做了一个如图所示的甲乙两个实验。
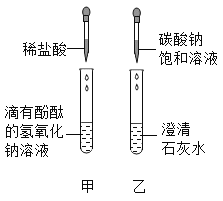
(1)写出乙实验的化学反应方程式_____,反应过程中产生的现象是_____。
实验结束后,甲、乙两个同学将废液倒入实验室的废液缸,结果发现废液浑浊并呈红色,产生疑问。
(提出问题)废液中含有哪些物质?
(交流讨论)①一定含有的物质:碳酸钙、指示剂、水和_____(写物质名称)。
②还含有能使废液呈碱性的物质。能使废液呈碱性的物质是什么?同学们有如下猜想。
小云认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是_____。(写一种猜想)
(实验设计)小方想用氯化钙溶液来验证小云、小红、小林的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小方的实验设计补充完整。
实验内容 | 预计现象 | 预计结论 |
取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置。 | ①有白色沉淀,溶液呈红色。 | _____的猜想正确。 |
②_____。 | _____的猜想正确。 | |
③_____。 | _____的猜想正确。 |
(反思拓展)在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑_____。