题目内容
【题目】定量研究对于化学科学发展有重大作用,因此我们应能利用质量守恒定律解决一些实际问题。
(1)某物质完全燃烧后生成二氧化碳和水。则该物质一定含有的元素是______
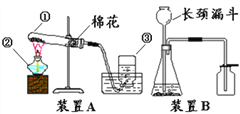
(2)下图A、B、C三个实验用于验证质量守恒定律,每个实验至少需要进行_____(填“1”“2”“3”)次称量;图A实验中气球的作用__________ ;做图B实验时,将试管中的盐酸与烧杯中的碳酸钠混合时看到的现象:________,这三个实验中不适合用于验证质量守恒定律的是_______选填序号)。
(3)取63.2g高锰酸钾,加热一段时间后停止,共收集到3.2g氧气。计算:
①已反应的高锰酸钾的质量为_______克。
②剩余固体中氧元素的质量分数为______。(精确到0.1%)
【答案】 C H 2 缓冲气压 产生大量气泡 B 31.6 37.3﹪
【解析】 (1)某物质在完全燃烧后,生成二氧化碳和水,说明该物质中一定含有碳元素和氢元素,而氧元素是否含有无法确定,这是因为该物质燃烧时,和氧气发生了反应,二氧化碳和水中的氧元素可能完全由氧气提供,也可能由该物质和氧气共同提供;(2)A、B、C三个实验用于验证质量守恒定律,每个实验至少需要进行反应前、反应后两次称量;图A实验中气球是调节气压;为了防止瓶内气体受热膨胀,使橡皮塞松动,导致白烟冒出或冷却后空气进入而在瓶口放置了一个小气球;作图B实验时,盐酸与碳酸钠粉末反应生成氯化钠和水和二氧化碳;故将试管中的盐酸与烧杯中的碳酸钠混合时看到的现象有气泡产生;这三个实验中实验B中装置为敞口的容器,所以反应中生成的气体要逸出而使反应后的质量小于反应前的质量,不适合用于验证质量守恒定律;(3)(1)解:设参加反应的高锰酸钾的质量为![]() ,
,
![]()
![]()
![]()
![]()
![]()
![]()
解得: ![]()
(2)剩余固体中氧元素的质量为: ![]()
所以剩余固体中氧元素的质量分数为: ![]() 。
。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】下列实验方案与实验结论相对应的是
选项 | ① | ② | ③ | ④ |
方案 |
|
|
|
|
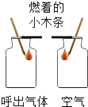
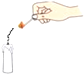
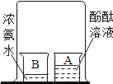
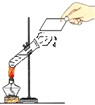
结论 | 比较呼出气体中CO2含量较空气中的多 | 说明白烟的成分不是二氧化碳 | 说明氨分子在不断地运动,而酚酞分子不运动 | 说明液态水与气态水可以相互转化 |
A. ①②④ B. ①④ C. ①②③④ D. ②④