题目内容
 33、金属与人类生活、生产密不可分.
33、金属与人类生活、生产密不可分.(1)我国多使用铁锅炒菜,这是利用了铁的
导热性
性质;专家建议市民多食用动物肝脏、芹菜等食物,这些食物富含铁,可减少缺铁性贫血疾病的发生,这里的“铁”是指(填字母)
B
.A.原子B.元素C.单质
(2)清末铝制艺术品至今保存完好,艺术品未被锈蚀的主要原因是(填字母)
C
.A.铝不易被氧化
B.铝的金属活动性比较弱
C.铝表面的氧化膜具有保护作用
(3)图1为金属与过量盐酸反应的关系图,其中A、B两条直线分别代表镁、铁、锌三种金属中的两种.
①A代表的是(填元素符号)
Zn
;写出B与盐酸反应的化学方程式
Mg+2HCl=MgCl2+H2↑
.②将上述的金属A与盐酸放入烧杯中,称得它们的总质量为M克,反应结束后再称量其质量为N克.请你在坐标系(图2)中画出反应过程中氯元素质量分数的变化曲线.
分析:金属具有良好的导热性;食物中的营养物质,如铁、钙等一般是指元素;铝的化学性质比较活泼,能和氧气反应生成一层致密而坚硬的氧化物薄膜,对铝起到保护作用;根据反应过程的图象可以判断反应物;根据反应物和生成物及其质量守恒定律可以书写化学方程式.
解答: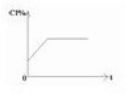 解:(1)铁具有良好的导热性,可以制作炊具.故填:导热性.
解:(1)铁具有良好的导热性,可以制作炊具.故填:导热性.
动物肝脏、芹菜等食物中富含铁,这里的铁是指铁元素.故填:B.
(2)因为铝的化学性质比较活泼,能和氧气反应生成一层致密而坚硬的氧化物薄膜,从而对铝起到保护作用.故填:C.
(3)①A中金属和氢气的质量比约为32.5:1,正好符合锌和盐酸反应生成氢气的质量比.B中金属和氢气的质量比约为12:1,正好符合镁和盐酸反应生成氢气的质量比.故填:Zn.
镁与盐酸反应的化学方程式为:Mg+2HCl=MgCl2+H2↑.
②在反应过程中氯元素的质量不变,随着生成的氢气的不断逸出,混合物的质量不断减少,氯元素的质量分数不断增大,完全反应后氯元素的质量分数不再改变.如图所示.
 解:(1)铁具有良好的导热性,可以制作炊具.故填:导热性.
解:(1)铁具有良好的导热性,可以制作炊具.故填:导热性.动物肝脏、芹菜等食物中富含铁,这里的铁是指铁元素.故填:B.
(2)因为铝的化学性质比较活泼,能和氧气反应生成一层致密而坚硬的氧化物薄膜,从而对铝起到保护作用.故填:C.
(3)①A中金属和氢气的质量比约为32.5:1,正好符合锌和盐酸反应生成氢气的质量比.B中金属和氢气的质量比约为12:1,正好符合镁和盐酸反应生成氢气的质量比.故填:Zn.
镁与盐酸反应的化学方程式为:Mg+2HCl=MgCl2+H2↑.
②在反应过程中氯元素的质量不变,随着生成的氢气的不断逸出,混合物的质量不断减少,氯元素的质量分数不断增大,完全反应后氯元素的质量分数不再改变.如图所示.
点评:解答本题要掌握化学方程式的书写方法,掌握金属的性质,充分理解元素质量分数的含义,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
金属与人类生活、生产密不可分。
⑴某小组设计右图装置来观察铁制品锈蚀的原因。
① 铁生锈的条件是 ;写出一条防止课桌腿生锈的方法 。
 ② 一段时间后,右图中可观察到 处锈蚀最严重和 的现象 。
② 一段时间后,右图中可观察到 处锈蚀最严重和 的现象 。
⑵锰为不锈钢主要的添加元素。锰的氧化物是不锈钢的保护膜,可以提高不锈钢的耐腐蚀性。
①相同温度下,取大小相同、表面光亮的锰、镁、铜三种金属片,分别投入足量的、质量分数相同的稀盐酸中(反应中锰的化合价为+2价),现象如下:
| 金属种类 | 锰(Mn) | 镁 | 铜 |
| 与盐酸反应 | 略慢 | 快 | 无明显现象 |
上述三种金属的活动性由弱到强的顺序是 ;写出锰与稀盐酸反应的化学方程式 。
②金属与酸的反应存在某种规律,请你分析下表中的数据,找到对应关系。
| 等质量的金属(a克)与足量盐酸反应 | 镁 | 铁 | 锰 |
| 金属的相对原子质量 | 24 | 56 | 55 |
| 产生氢气的质量(g) | a/12 | a/28 | a/27.5 |
| 找到的规律 |
| ||

 上述三种金属的活动性由弱到强的顺序是
上述三种金属的活动性由弱到强的顺序是
 金属与人类生活、生产密不可分.
金属与人类生活、生产密不可分.