题目内容
实验中学程实同学在一围墙上偶然看到一则化肥广告(如下图)。回校后,程实同学通过计算氮的质量分数发现该广告是虚假广告。
(1)请你写出程实的计算过程和判断依据。
计算过程:
结论:
(2)程实同学认为此广告会坑害农民,向有关部门反映,技术监督局对该产品取样分析,发现氮元素质量分数仅为28.0%,则该产品中硝酸铵的质量分数为?写出计算过程。
(1)计算过程:纯净硝酸铵中氮元素的质量分数=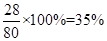 ;35%<38% 此广告为虚假广告。(2) 设NH4NO3质量为X,广告中硝酸铵的质量为Y,则得方程式为
;35%<38% 此广告为虚假广告。(2) 设NH4NO3质量为X,广告中硝酸铵的质量为Y,则得方程式为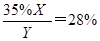 ,可得X:Y=4:5,则该产品中硝酸铵的质量分数为80%.
,可得X:Y=4:5,则该产品中硝酸铵的质量分数为80%.
解析试题分析:(1)分析该题可得计算出纯净的硝酸铵中的氨的质量分数,看是否可达38%即可.(2)可通过设硝酸铵质量为X,总质量为Y,以混合后氮元素的质量分数为28%为等量关系来计算.
考点:元素的质量分数计算;化合物中某元素的质量计算;混合物中某元素的质量计算;标签上标示的物质成分及其含量。

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
钙是维持人体正常功能所必需的元素。
如图所示为某种补钙剂“钙尔奇”说明书的一部分。取1片钙尔奇,放入盛有10 g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其他成分与盐酸不反应)。烧杯内物质质量变为11.34 g。试计算:
| 钙尔奇 caltrate 主要成分:CaCO3 规格:每片2.0 g 用法:口服 用量:一日2次,每次1片 |
(1)每片钙尔奇中含碳酸钙的质量。
(2)服用这种补钙剂,每人每天摄入钙元素的质量。
(3)所用稀盐酸中溶质的质量分数。
在反应A+B=C+D中,20g A和10g B恰好完全反应,生成5g C,若要制得5g D,则需要B的质量为( )
| A.5g | B.4g | C.2g | D.3g |

 CO+H2.若生产1t氢气,计算所需碳的质量.
CO+H2.若生产1t氢气,计算所需碳的质量.