题目内容
金属在生产生活中应用广泛,根据所学知识回答以下问题。
(1)以下用品中,主要利用金属导电性的是 (填字母序号)。


A.铝箔 B.铜导线 C.炒锅
(2)目前世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20%~40%。铁制品在空气中会发生锈蚀,其原因是铁与空气中的_________共同作用的结果;汽车外表面防锈的主要措施是_________。
(3)向盛有硫酸铜溶液的试管中插入一根铁丝,过一会观察铁丝表面的现象为 ,发生反应的化学方程式为 。
(4)将木炭粉和氧化铁粉末的混合物加热(如图所示)一段时间,观察到澄清石灰水变浑浊;向反应后的固体中加入过量的稀盐酸,固体全部溶解且有气泡出现。根据现象判断,木炭和氧化铁反应的生成物中一定含有________。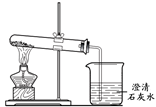
(1)B (2) 水和氧气 喷漆
(3)铁丝表面有红色物质析出 Fe+CuSO4=Cu+FeSO4
(4)铁和二氧化碳
解析试题分析:(1)制成铝箔是利用铝的延展性;铜作导线是利用铜的导电性;铁作锅是利用金属的导热性;
(2)铁生锈的条件是要和水、氧气同时接触;汽车外表面防锈的主要措施是喷漆以隔绝水和氧气;
(3)铁的活动性比铜强,能把硫酸铜溶液中的铜置换出来:Fe+CuSO4=Cu+FeSO4 ,现象是铁丝表面有红色物质析出;
(4)固体全部溶解且有气泡出现,说明反应后的固体中没有碳,只有铁,由于木炭能还原氧化铁生成铁和二氧化碳,故木炭和氧化铁反应的生成物中一定含有铁和二氧化碳。
考点:金属、铁生锈的条件

铁及其化合物在生活生产中有重要的应用。请回答下列问题:
(1)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是___________________________________,为防止集气瓶破裂,常采取的措施是__________________________________________________________________。
(2)已知铁能与氯化铁反应生成氯化亚铁。将生锈的铁钉(铁锈的主要成分是Fe2O3)放入盐酸中,充分反应后有铁剩余,写出发生置换反应的化学方程式_____________________________________,溶液中的金属阳离子是____________(用符号表示)。
(3)高炉炼铁中,焦炭的作用是_______________________________________________________________(用化学方程式表示)。
(4)把铁粉和铜粉的混合物放入硝酸银溶液中,反应结束后有固体剩余。下列说法正确的是____________(填写字母序号)。
| A.剩余固体肯定含有银 | B.剩余固体肯定是银和铜 |
| C.反应后溶液中一定有Fe2+和Cu2+ | D.反应后溶液中可能含有Ag+和Cu2+ |
生活中常用的不粘锅,其内衬用的一种材料叫聚四氟乙烯。该材料属于( )
| A.金属材料 | B.纳米材料 | C.复合材料 | D.有机合成材料 |
市场上“即热饭盒”中的化学反应是:Mg+2H2O → Mg(OH)2+H2↑,其中氧化剂是
| A.Mg | B.H2O | C.Mg(OH)2 | D.H2 |
如下图所示,将足量的某铁粉用水均匀地粘在试管内壁上,将试管倒立在装有水的烧杯中。实验过程中,观察到试管内液面缓慢上升。下列分析错误的是
| A.水能进入试管的最大体积约为试管容积的1/5 |
| B.该铁粉在试管内发生了氧化反应 |
| C.这一实验可以验证空气的组成不是单一的 |
| D.如把该铁粉改为木炭粉,两者的现象完全相同 |