题目内容
【题目】宏观辨识与微观探析是化学学习的独特思维。对于溶液中进行的反应及其规律,通过反思与探索,同学们有了新的认识。请回答下列问题:
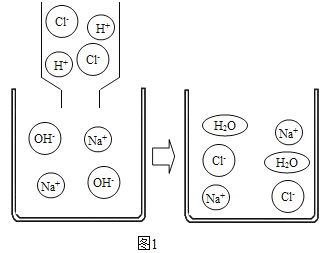
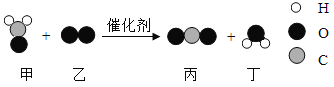
(1)向滴有酚酞的氢氧化钠溶液滴加稀盐酸,完全反应时的现象是_____;反应的微观示意图如图1,反应能进行的原因是溶液中H+和OH-的数目减少,即自由移动的离子数目减少,反应的实质:_____。
(2)碳酸钠溶液中滴加盐酸反应现象为_____,反应实质:2H++CO32-=_____。
(3)铝和硫酸铜溶液反应的过程如下图2所示:
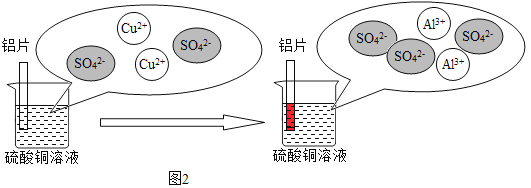
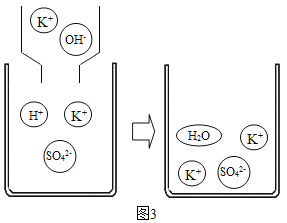
图2烧杯中发生反应的方程式为_____,溶液的质量变化是_____(填写“增大”“减少”“不变”),从微观粒子变化的角度分析铝片在硫酸铜溶液中反应的实质是_____。
(4)如图3所示向KHSO4溶液中滴加KOH溶液,反应的实质是_____。
(5)化学反应前后一定不发生改变的是_____。
A 分子种类
B 原子种类
C 元素种类
D 元素化合价
【答案】溶液红色消失 ![]() (或氢离子和氢氧根离子结合生成水分子) 有气体生成
(或氢离子和氢氧根离子结合生成水分子) 有气体生成 ![]()
![]() 减少
减少 ![]() (或铝原子和铜离子反应生成铝离子和铜原子)
(或铝原子和铜离子反应生成铝离子和铜原子) ![]() (或氢离子和氢氧根离子结合生成水分子) BC
(或氢离子和氢氧根离子结合生成水分子) BC
【解析】
(1)氢氧化钠溶液显碱性,能使无色的酚酞试液变红色,滴加稀盐酸后,氢氧化钠中的氢氧根离子与盐酸中的氢离子结合成水,溶液的碱性减弱,当二者恰好中和时,溶液呈中性,溶液由红色变成无色;
反应的实质是氢离子和氢氧根离子结合生成水;
(2)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,实验中观察到有气泡产生,反应的实质是碳酸钠中的碳酸根离子与盐酸中的氢离子结合成二氧化碳分子和水分子;
(3)铝和硫酸铜发生置换反应生成铜和硫酸铝,化学方程式为2Al+3CuSO4=3Cu+Al2(SO4)3;由化学方程式可知,每54份质量的铝能置换出192份质量的铜,溶液的质量变小;由微观反应示意图可知,铝片在硫酸铜溶液中反应的实质是2Al+3Cu2+=3Cu+2Al3+;
(4)如图3所示向KHSO4溶液中滴加KOH溶液,反应的实质是氢离子与氢氧根离子结合成水分子;
(5)化学反应前后,分子种类一定改变,原子种类和元素种类一定不变,元素的化合价可能改变,也可能不变。

 字词句段篇系列答案
字词句段篇系列答案【题目】某化学兴趣小组在制取氧气时,用带火星木条伸入瓶中发现没有复燃,对于此问题展开探究。
[提出假设]气体中氧气体积分数达到多少时才能使带火星的木条复燃?
(设计方案)
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
瓶中水量 | 10% | 20% | 30% | 40% | 50% | 60% | 70% | 80% | 90% |
氧气体积分数 | 28.9% | 36.8% | 44.7% | 52.6% | 60.5% | 68.4% | 76.3% | 84.2% | 92.1% |
带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |
[实验探究]写出用过氧化氢溶液制取氧气化学方程式_______。
[反思评价]
(1)你认为能使带火星木条复燃的所需氧气体积分数的取值范围为_________。
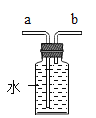
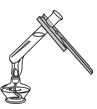
(2)同学们结合教材中提到验证空气中氧气体积分数的实验(如图所示),你认为该实验测量的氧气体积分数精确吗?_______,请说明理由_______。
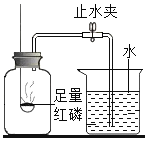
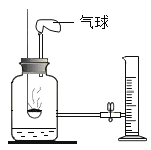
[交流表达]为此该小组进一步探究,对上述实验进行了改进,设计如下图实验,请回答下列问题:
(1)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],写出该反应的化学方程式_________。

测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶 (扣除内容物) 和导管的容积 | |
体积/mL | 80.0 | 54.5 | 126.0 |
(2)根据以上数据计算,改进实验后测得的空气中氧气的体积分数是____________(计算结果精确到0.1%)。
(3)此实验中食盐水的作用是__________________。
(4)从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是①________;②_________。