题目内容
【题目】初中化学课上,同学们利用下列实验探究碱的化学性质:

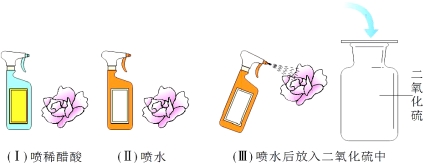
1)A实验中观察到的现象为 ,原因是(用化学方程式表示) 。
2)B实验中反应的化学方程式为 。
3)C实验中观察到的现象是 。
4)实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色。
【提出问题】废液中含有什么物质?
【假设猜想】通过分析上述实验,同学们猜想:废液中除酚酞、碳酸钙及水以外一定含有 。
老师问:废液中还可能有什么物质?引发同学们热烈讨论,下面是大家的发言:
学生甲 | 可能有Ca(OH)2、NaOH | 学生丙 | 可能有Ca(OH)2、CaCl2 |
学生乙 | 可能有NaOH、Na2CO3 | 学生丁 | 可能有Na2CO3 |
学生戊 | 可能有NaOH | …… | ………… |
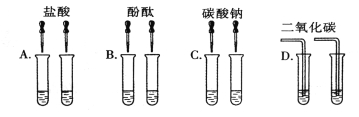
【实验验证】同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钡溶液,得到白色沉淀,红色褪去。
【结论】上述滤液中,还含有 ,没有 。
【答案】1)溶液红色逐渐褪去, HCl + NaOH = NaCl + H2O
2)CO2 + 2NaOH = Na2CO3 + H2O
3)有白色浑浊生成(或白色沉淀生成)
4)【猜想】NaCl
【结论】Na2CO3, CaCl2、Ca(OH)2 、NaOH
【解析】
试题分析:1)氢氧化钠溶液呈碱性,可使酚酞变红。当加入稀盐酸后,二者发生中和反应。随着稀盐酸的加入,溶液的碱性会逐渐减弱至中性或酸性。观察的现象是:溶液红色会逐渐褪去。反应的化学方程式为:HCl + NaOH = NaCl + H2O
2)B中的二氧化碳会与氢氧化钠反应生成碳酸盐和水,反应的化学方程式为:CO2 + 2NaOH = Na2CO3 + H2O
3)石灰水是氢氧化钙的水溶液,会与碳酸钠反应生成白色的难溶于水的碳酸钙和水。所以反应的现象为:有白色沉淀生成。
4)【猜想】A中会生成氯化钠。且氯化钠不与后面的物质反应,因此一定存在。B中会生成碳酸钠。实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色。说明C中的氢氧化钙有剩余,并与B中生成的碳酸钠反应生成碳酸钙沉淀而浑浊。由于碳酸钠参与了反应,所以它不一定存在,而是可能存在。显红色说明溶液呈碱性。在上述实验中呈碱性的有氢氧化钠、碳酸钠或氢氧化钙。无法确定哪一种。如A中盐酸有剩余,则可能存在还有氯化钙。因此一定存在的是氯化钠。
【结论】取一定量的废液过滤,向滤液中逐滴加入氯化钡溶液,得到白色沉淀,红色褪去。说明溶液中存在的碱性物质能与氯化钡反应,所以应为碳酸钠。由氯化钙、氢氧化钙一定不存在。最终溶液为无色,可确定氢氧化钠也不存在。