题目内容
某一密闭容器中盛有H2、O2的混合气体共10g,经电火花点燃充分反应后,测得生成水的质量为9g,则原混合气体中H2和O2的质量比可能为( )
分析:因为生成了9g水,则说明参加反应的混合气体总质量也为9g,而原气体总质量为10g.所以还有1g气体没有反应,可能是H2,也有可能是O2.根据化学方程式,分别计算出两种情况下原混合气体中H2和O2的质量,进行比较即可.
解答:解:假设氢气完全反应,设原混合气体中H2质量为x,
2H2+O2
2H2O
4 36
x 9g
=
解得:x=1g
则消耗的O2的质量为9g-1g=8g,
当剩余1g气体为氢气时,则氢气和氧气的质量比为:(1g+1g):8g=1:4
当剩余1g气体为氧气时,则氢气和氧气的质量比为:1g:(1g+8g)=1:9
分析所给的选项可以知道选项BD是正确的.
故选:BD.
2H2+O2
| ||
4 36
x 9g
| 4 |
| x |
| 36 |
| 9g |
解得:x=1g
则消耗的O2的质量为9g-1g=8g,
当剩余1g气体为氢气时,则氢气和氧气的质量比为:(1g+1g):8g=1:4
当剩余1g气体为氧气时,则氢气和氧气的质量比为:1g:(1g+8g)=1:9
分析所给的选项可以知道选项BD是正确的.
故选:BD.
点评:本题主要考查学生利用化学方程式进行计算的能力.学生需认真分析可能存在的各种情况,才能正确答题.

练习册系列答案
相关题目
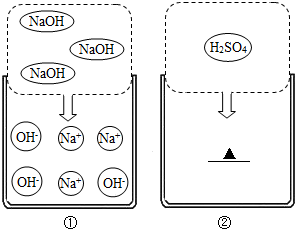
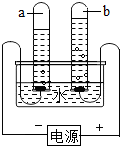
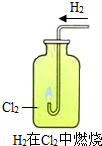



 2HCl.
2HCl.


 2HCl.
2HCl.