题目内容
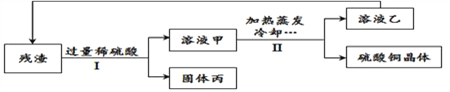
【题目】以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图:

已知:①SiO2不溶于酸 ②Fe2(SO4)3 + Fe == 3FeSO4
回答下列问题:
(1)酸浸、过滤后滤液A中的金属阳离子是_______________。
(2)步骤Ⅱ中加入足量的铁粉目的是除去过量的酸,还可能有的作用是________________________。
(3)煅烧FeCO3生成产品I的化学反应方程式为______________________。
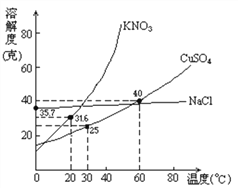
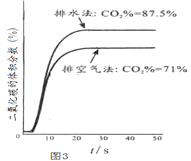
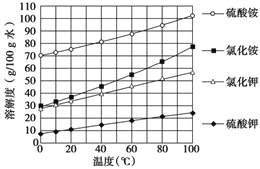
(4)已知几种盐的溶解度随温度变化的曲线如下图所示,产品Ⅱ的化学式为_____________,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是蒸发浓缩、__________、洗涤、干燥。
(5)检验产品Ⅱ晶体中是否含有少量的氯化物杂质需用到的试剂是________________________。
(6)步骤Ⅲ中可选用__________________(填序号)试剂调节溶液的pH。
A.稀硝酸 B.双氧水 C.氨水
【答案】 Fe3+、Fe2+ 将Fe3+还原为Fe2+ ![]() K2SO4 趁热过滤 Ba(NO3)2溶液、AgNO3溶液 C
K2SO4 趁热过滤 Ba(NO3)2溶液、AgNO3溶液 C
【解析】(1)根据硫铁矿烧渣的成分,其中二氧化硅不与酸反应,氧化亚铁与酸反应生成亚铁盐,溶液中有亚铁离子,氧化铁与酸反应生成三价铁的盐,溶液中有铁离子,所以滤液A的成分中含有的金属阳离子有:Fe3+、Fe2+;(2)由题中信息可知Fe2(SO4)3 + Fe == 3FeSO4,步骤Ⅱ中加入足量的铁粉目的是除去过量的酸,还能使铁离子全部转化为亚铁离子;(3)由流程图可知煅烧碳酸亚铁后生成氧化铁,所以该反应的化学方程式为4 FeCO3+ O2![]() 2 Fe2O3+4 CO2;(4)产品II是无氯钾肥,所以产品II是硫酸钾,化学式为K2SO4;向(NH4)2SO4溶液中加入KCl溶液后,根据几种盐的溶解度曲线,可知同温下硫酸钾的溶解度较小,氯化铵的溶解度较大,所以还需要进行的操作是蒸发结晶,将硫酸钾以晶体形式析出,趁热过滤、洗涤、干燥,即可得到产品II;(5)因为产品II是硫酸钾,若要检验含有氯化物,则应先除去硫酸根离子,以免给氯离子的检验带来干扰,所以应选择的试剂是Ba(NO3)2溶液(除掉硫酸根离子)、AgNO3溶液(通过是否生成白色沉淀验证氯离子);(6)稀硝酸、双氧水都具有强氧化性,易把亚铁离子氧化为铁离子,同时给溶液带来新的杂质,所以选择氨水调节pH,而且在后面的步骤中加入了铵盐,所以不会引入新的杂质,答案选C。
2 Fe2O3+4 CO2;(4)产品II是无氯钾肥,所以产品II是硫酸钾,化学式为K2SO4;向(NH4)2SO4溶液中加入KCl溶液后,根据几种盐的溶解度曲线,可知同温下硫酸钾的溶解度较小,氯化铵的溶解度较大,所以还需要进行的操作是蒸发结晶,将硫酸钾以晶体形式析出,趁热过滤、洗涤、干燥,即可得到产品II;(5)因为产品II是硫酸钾,若要检验含有氯化物,则应先除去硫酸根离子,以免给氯离子的检验带来干扰,所以应选择的试剂是Ba(NO3)2溶液(除掉硫酸根离子)、AgNO3溶液(通过是否生成白色沉淀验证氯离子);(6)稀硝酸、双氧水都具有强氧化性,易把亚铁离子氧化为铁离子,同时给溶液带来新的杂质,所以选择氨水调节pH,而且在后面的步骤中加入了铵盐,所以不会引入新的杂质,答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】化学能帮助我们更好地认识生活、改善生活。
(1)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含量表:
营养成分 | 含量(每100 g) | 营养成分 | 含量(每100 g) |
水分 | 9.9 g | 钙元素 | 23.00 mg |
脂肪 | 0.2 g | 铁元素 | 1.10 mg |
蛋白质 | 4.8 g | 硒元素 | 0.02 mg |
淀粉 | 82.5 g | 其他 | …… |
① 紫薯中能为人体提供能量的营养物质为脂肪、淀粉和_______;
②以上营养成分中_____(填元素符号,下同)是人体中含有的微量元素,______摄入不足,会导致骨质疏松、佝偻病;
③在酶的作用下,淀粉先水解为葡萄糖,葡萄糖再转化为乙醇和二氧化碳。写出葡萄糖转化为乙醇的化学方程式__________________。
(2)创新发展材料技术可推动人类社会进步。
①石墨烯可用作太阳能电池的电极,这里主要利用了石墨烯的________性;
②高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于________(填字母);
a.金属材料 b.无机非金属材料 c.有机高分子材料
③高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是________(填字母);
a.铜 b.石墨 c.二氧化硅
④基础工程建设中常用到水泥、玻璃、钢材等。在钢材中添加铬、镍等元素的目的是______。