题目内容
(7分)碳酸氢钠是一种重要的盐类物质,在生活中用途广泛。小红同学设计实验对碳酸氢钠的性质进行了探究。请你参与她的探究活动。
【探究实验1】碳酸氢钠溶液的酸碱性。
【实验方案】取少量该固体于试管中,加适量水溶解,再滴入几滴酚酞试液,振荡。
现象:溶液变成浅红色。 结论: ① 。
【探究实验2】能与酸反应。
【实验方案】取少量该固体加入试管中,滴加稀盐酸。
现象: ② 。反应的化学方程式为: ③ 。
【探究实验3】碳酸氢钠的热稳定性。
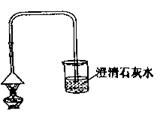
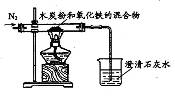
【实验方案】设计实验装置如右图,并进行实验。

现象: 试管口有水珠出现,澄清石灰水变浑浊。充分加热后,试管中留下白色固体。
结论:碳酸氢钠受热有二氧化碳、水和白色固体生成。
请你帮小红设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH。
(所选试剂不能用酸)
步骤: ④ ;现象: ⑤ 。
试写出碳酸氢钠受热发生反应的化学方程式: ⑥ 。
【拓展应用】请说出碳酸氢钠在日常生活中的一种用途: ⑦ 。
【探究实验1】碳酸氢钠溶液的酸碱性。
【实验方案】取少量该固体于试管中,加适量水溶解,再滴入几滴酚酞试液,振荡。
现象:溶液变成浅红色。 结论: ① 。
【探究实验2】能与酸反应。
【实验方案】取少量该固体加入试管中,滴加稀盐酸。
现象: ② 。反应的化学方程式为: ③ 。
【探究实验3】碳酸氢钠的热稳定性。
【实验方案】设计实验装置如右图,并进行实验。

现象: 试管口有水珠出现,澄清石灰水变浑浊。充分加热后,试管中留下白色固体。
结论:碳酸氢钠受热有二氧化碳、水和白色固体生成。
请你帮小红设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH。
(所选试剂不能用酸)
步骤: ④ ;现象: ⑤ 。
试写出碳酸氢钠受热发生反应的化学方程式: ⑥ 。
【拓展应用】请说出碳酸氢钠在日常生活中的一种用途: ⑦ 。
(1)碳酸氢钠溶液显碱性 (2)有气泡产生
(3)NaHCO3+HCl=NaCl+H2O+CO2↑
(4)取试管中反应后剩下的白色固体,加水溶解,滴入氢氧化钡溶液
(5)有白色沉淀产生
(6)2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(7)焙制糕点的发泡剂
(3)NaHCO3+HCl=NaCl+H2O+CO2↑
(4)取试管中反应后剩下的白色固体,加水溶解,滴入氢氧化钡溶液
(5)有白色沉淀产生
(6)2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑(7)焙制糕点的发泡剂
①因为碱性溶液能使酚酞变红,所以此现象说明碳酸氢钠溶液呈碱性.
②碳酸氢钠和盐酸反应二氧化碳气体,所以会看到溶液中能产生气泡.
③反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑.
④碳酸钠能和氢氧化钙反应生成沉淀,而氢氧化钠和氢氧化钙不反应,故取少量该固体加入试管中,加适量水溶解,再滴入澄清石灰水;
⑤从反应生成了二氧化碳,且二氧化碳能使澄清石灰水溶液变浑浊.
⑥碳酸氢钠受热发生反应的化学方程式2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
⑦碳酸氢钠能和酸反应生成二氧化碳,故可以用作治疗胃酸的药物(或用作焙制糕点的发泡剂).
②碳酸氢钠和盐酸反应二氧化碳气体,所以会看到溶液中能产生气泡.
③反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑.
④碳酸钠能和氢氧化钙反应生成沉淀,而氢氧化钠和氢氧化钙不反应,故取少量该固体加入试管中,加适量水溶解,再滴入澄清石灰水;
⑤从反应生成了二氧化碳,且二氧化碳能使澄清石灰水溶液变浑浊.
⑥碳酸氢钠受热发生反应的化学方程式2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑⑦碳酸氢钠能和酸反应生成二氧化碳,故可以用作治疗胃酸的药物(或用作焙制糕点的发泡剂).

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目