题目内容
为了测定某碳酸钠样品中杂质氯化钠的质量分数,李明同学进行了三次实验,反应的化学方程方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl。实验数据如下表:
| 编 号 | 第1次 | 第2次 | 第3次 |
| 所取固体样品的质量/g | 7 | 5 | 5 |
| 加入氯化钙溶液的质量/g | 50 | 50 | 75 |
| 反应后生成沉淀的质量/g | 4 | 4 | 4 |
完成下列计算:
(1)碳酸钠样品中碳酸钠的质量是多少?
(2)加入氯化钙溶液的溶质质量分数是多少?
(3)碳酸钠样品中杂质氯化钠的质量分数是多少?
(1)解:由题意,设碳酸钠的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x 4g
106 : 100 = x : 4g
X=4.24 g (2分)
(2)设参加反应的氯化钙质量为y
Na2CO3+CaCl2=CaCO3↓+2NaCl
111 100
y 4g
111 : 100= y : 4g
y=4.44 g (2分)
分析李明的实验数据可知,第2次恰好完全反应。 (1分)
加入的氯化钙溶液的溶质质量分数为: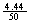 ×100%=8.88% (1分)
×100%=8.88% (1分)
(3)碳酸钠样品中杂质氯化钠的质量: 5g-4.24g=0.76 g (1分)
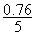 氯化钠的质量分数: ×100%=15.2% (1分)
氯化钠的质量分数: ×100%=15.2% (1分)
(其他解法,只要合理且答案正确均给分)

为了测定某碳酸钠样品中杂质氯化钠的质量分数,李明同学进行了三次实验,反应的化学方程方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl.实验数据如下表:
| 编 号 | 第1次 | 第2次 | 第3次 |
| 所取固体样品的质量/g | 7 | 5 | 5 |
| 加入氯化钙溶液的质量/g | 50 | 50 | 75 |
| 反应后生成沉淀的质量/g | 4 | 4 | 4 |
(1)碳酸钠样品中碳酸钠的质量是多少?
(2)加入氯化钙溶液的溶质质量分数是多少?
(3)碳酸钠样品中杂质氯化钠的质量分数是多少?
为了测定某碳酸钠样品中杂质氯化钠的质量分数,李明同学进行了三次实验,反应的化学方程方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl。实验数据如下表:
| 编 号 | 第1次 | 第2次 | 第3次 |
| 所取固体样品的质量/g | 7 | 5 | 5 |
| 加入氯化钙溶液的质量/g | 50 | 50 | 75 |
| 反应后生成沉淀的质量/g | 4 | 4 | 4 |
完成下列计算:
(1)碳酸钠样品中碳酸钠的质量是多少?
(2)加入氯化钙溶液的溶质质量分数是多少?
(3)碳酸钠样品中杂质氯化钠的质量分数是多少?
为了测定某碳酸钠样品中杂质氯化钠的质量分数,李明同学进行了三次实验,反应的化学方程式为:Na2CO3+CaCl2===CaCO3↓+2NaCl。实验数据如下表:
| 编 号 | 第1次 | 第2次 | 第3次 |
| 所取固体样品的质量/g | 7 | 5 | 5 |
| 加入氯化钙溶液的质量/g | 50 | 50 | 75 |
| 反应后生成沉淀的质量/g | 4 | 4 | 4 |
完成下列计算:
(1)反应的碳酸钠样品中碳酸钠的质量是多少?
(2)加入氯化钙溶液的溶质质量分数是多少?
(3)碳酸钠样品中杂质氯化钠的质量分数是多少?