��Ŀ����
����Ŀ��ˮ��һ����Ҫ����Դ���������������д����벻��ˮ��ˮ��Һ��
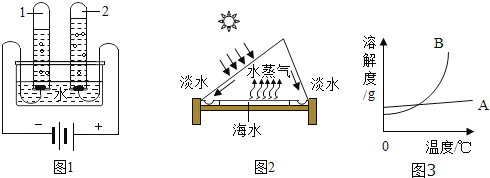
��1�����ˮʵ���ʾ��ˮ����ɣ�ͼ1ʵ���еõ��������Թ��� ���1����2������
��2������ˮ����ˮ�������õ�����̿���������� ��
��3��������Ա���ø�ѹˮǹ���������ԭ���� ��
��4�����������ʷֱ����ˮ�У������γ���Һ���� ������ţ�
A������ B��������̼ C��ʳ�� D���ƾ�
��5����ˮ�����ɻ��ˮ��Դ�ѷ������⣬ͼ2Ϊ̫���ܺ�ˮ����װ��ʾ��ͼ��
��ˮ���ˮ�����Ĺ����У��������仯���� ������ĸ��ţ�
A���������� B���������� C�����Ӽ��
�����ø�װ�ý�һ�����ĺ�ˮ��ɹһ��ʱ���ʣ�ຣˮ���Ȼ��Ƶ����������� ����������С�����䡱��
��6������75g6%���Ȼ�����Һʱ���漰����ʵ�鲽�裺
A����������ȡ B������ C���ܽ� D��װƿ����ǩ��
����ȷ��ʵ�鲽���� ������ĸ����������Ͳ��ȡˮʱ���Ӷ���������������ȷ����������Һ���������� 6%�����������������=������С����pH��ֽ���������Һ���õ��Ȼ�����Һ��pH 7�����������������=�������Ȼ�����Һ�ܵ�������Ϊ���������ƶ��� ���������ţ����������Ȼ�����Һȫ��ϡ�ͳ�Ũ��Ϊ0.9%��������ˮ�������ټ�ˮ g��
��7��������Ȼ��ƺ�������ڲ�ͬ�¶��µ��ܽ�ȣ������ܽ�ȱ����ܽ�����ش��������⣺
�¶�/�� | 10 | 30 | 50 | 60 | |
�ܽ��/g | �Ȼ��� | 35.8 | 36.3 | 37.0 | 37.3 |
����� | 20.9 | 45.8 | 85.5 | 110 |
��ͼ3���ܱ�ʾ�Ȼ��Ƶ��ܽ�������� ���A����B������
��60��ʱ��100gˮ�м���90g����أ�����ܽ⣬������Һ�� ������͡������͡�����Һ��������Һ���µ�10��ʱ���������������Ϊ g��
�۸��ݱ����֪���Ȼ��ƺ�������������ܽ�ȹ���ȵ��¶ȷ�Χ�� ��֮�䣮
��60��ʱ���õ��������Ȼ��ơ�����طֱ��������ֱ�����Һ���������������Ϊm1g��m2g����m1 m2�������������������=����
�����в������裺a���ܽ� b������ c�����½ᾧ d������Ũ������ij����ع����к��������Ȼ��ƣ����ᴿ����صIJ��������� ������ţ���
���𰸡���1��2����2�������ԣ�
��3�����Ϳ�ȼ����¶ȣ�
��4��A����5����A��B���ڱ��
��6��BACD������=��Na+��Cl����425g��
��7��A�������ͣ�69.1g��10��30������adcb��
����������1���ɵ��ˮװ��ʾ��ͼ��֪��2�Թ���������ǵ�Դ�ϵ��������������壬��������
��2������ˮ����ˮ�������õ�����̿�����������������ã�
��3��������Ա���ø�ѹˮǹ���������ԭ���ǽ��Ϳ�ȼ����¶ȣ�
��4��A���������ˮ�У������γ���Һ��
B��������̼����ˮ������̼����Һ��
C��ʳ�μ���ˮ�У������Ӻ������ӻ���ȵķ�ɢ��ˮ�У��γɾ�һ���ȶ��Ļ���������Һ��
D���ƾ�������ˮ���γɾ�һ���ȶ��Ļ���������Һ��
��5��ˮ���ˮ�����Ĺ������������仯�����������ͷ�������䣬���Ӽ���ı䣻��һ�����ĺ�ˮ��ɹһ��ʱ����ܼ����٣����ʲ��䣬ʣ�ຣˮ���Ȼ��Ƶ�������������
��6������������������һ������Һ�Ļ������裺���㡢�������ܽ⡢װƿ��ţ�����˳��ΪB��A��C��D��
��Ͳ��ȡ����ˮʱ���Ӷ�������ʹ����ˮ�٣�������õ���ҺŨ�Ȼ�ƫ�ߣ�
��pH��ֽ���������Һ���õ��Ȼ�����Һ��pH=7���Ȼ�������ˮ����ˮ���ӵ����������������ƶ��������Ӻ������ӣ���NaCl��Һ�ܵ�������Ϊ�����������ƶ�������Na+��Cl����
�����ټ�ˮ������Ϊx
75g��6%=��75g+x����0.9%
x=425g
��7�������ܽ�ȱ����Կ������Ȼ��Ƶ��ܽ�����¶�Ӱ�첻��A���Ȼ��Ƶ��ܽ�����ߣ�
��60��ʱ������ص��ܽ��Ϊ110g����100gˮ�м���90g�������ȫ���ܽ⣬�γɲ�������Һ��10��ʱ������ص��ܽ��Ϊ20.9g���ʽ���10�������ܽ�20.9g����أ����������������90g��20.9g=69.1g��
�۸��ݱ����֪���Ȼ��ƺ�������������ܽ�ȹ���ȵ��¶ȷ�Χ��10��30��֮�䣮
����60��ʱ���õ��������Ȼ��ơ�����طֱ��������ֱ�����Һ���Ȼ��Ƶ��ܽ��С������أ����Ȼ�����Ҫ��ˮ��������������أ��������������Ϊm1g��m2g����m1��m2��
����ij����ع����к��������Ȼ��ƣ����ᴿ����صIJ��������ǣ��ܽ⡢����Ũ�������½ᾧ�����ˣ�

����Ŀ��������ͼ��ʾװ�ûش����⣺

��1��д���������������ƣ��� �� ��
��2��ʵ��������Bװ������ȡ������̼��Ӧ������©������ ������Gװ�����ռ�������̼��������̼Ӧ�� ���루ѡ��a����b���������ѡ��װ��C��ȡ������̼����Bװ����ȣ����ŵ��ǣ� ��
��3���ò��Ӵ����ķ�����ȡ������ѡ��ķ���װ���� ����Ӧ�Ļ�ѧ����ʽ ����ѡ��Gװ�ã�����װ��ˮ���ռ�������������Ӧ�� ͨ�루ѡ��a����b������
��4��ij��ѧ��ȤС�����ⶨһ��ʯ��ʯ��Ʒ��̼��Ƶ�����������������Ʒ�е����ʲ�����ˮҲ�������ᷴӦ������15.0gʯ��ʯ��Ʒ�����ձ��У���ȡ100gϡ�����4�μ����ձ��У�ÿ�ξ���ַ�Ӧ��ʵ�����ݼ�¼���£�
�� �� | ��1�� | ��2�� | ��3�� | ��4�� |
����ϡ��������/g | 25 | 25 | 25 | 25 |
��Ӧ���ձ������ʵ�������/g | m | 61.4 | 85.6 | 110.6 |
�Լ��㣺
�����ɶ�����̼�������� g
�ڵ�1�μ���ϡ�����ַ�Ӧ���ձ������ʵ�������mΪ
�۸�ʯ��ʯ��Ʒ��̼��Ƶ�����������д��������̣���
