题目内容
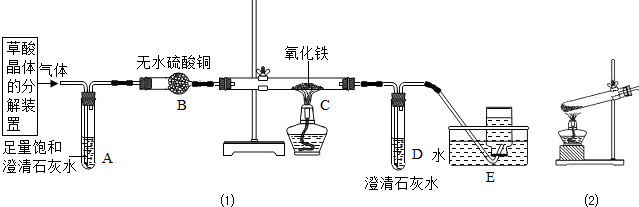
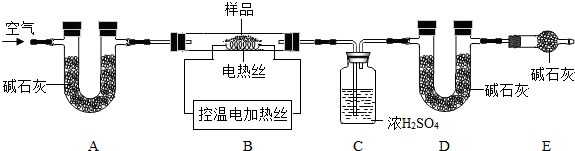
(1)某实验小组在研究二氧化碳的性质时,根据下图进行实验。
请回答:A中的现象是______,B中反应的化学方程式是______。
(2)该小组利用对比的方法研究二氧化硫的性质,
进行如下探究。
【提出问题】二氧化硫与二氧化碳均属于非金属氧化物,是否具有相似的化学性质呢?
【查阅资料】二氧化硫具有漂白性,其原因是二氧化硫与某些有色物质(如品红溶液)反应生成不稳定的无色物质,实验室常用红色的品红溶液检验二氧化硫的存在。
【实验探究】实验装置如右图所示。
①装置C中紫色石蕊溶液变红,是由于二 氧化硫与水反应生成了亚硫酸(H2SO3);装置D中澄清石灰水变浑浊,该反应的化学方程式是______。
②装置E的试管中溶液变无色,取该溶液加热,溶液又变为红色,其原因是______。
③此装置有一个明显的不足之处是______。
④活性炭也能使品红溶液褪色,其褪色原理与二氧化硫
使品红溶液褪色的原理不相同,其理由是______。
【反思提高】某同学将二氧化硫通入到紫色的酸性高锰酸钾溶液中,观察到溶液由紫色变为无色,由此他得出的结论是:二氧化硫能将酸性高锰酸钾溶液漂白。请你设计实验证明此结论是否正确(要求写出操作、现象、结论):______。
二氧化硫与二氧化碳有相似的化学性质,但二氧化硫还具有某些特殊的化学性质。


【解析】(1)二氧化碳与水反应生成碳酸,碳酸使紫色石蕊溶液变红色,二氧化碳和氢氧化钙反应能生成不溶于水的碳酸钙
(2)二氧化硫密度比空气大,易溶于水且与水反应生成亚硫酸,还能与碱反应生成亚硫酸盐
【答案】(1)溶液变红,CO2+ Ca(OH)2= CaCO3↓+H2O
(2)①SO2+ Ca(OH)2= CaSO3↓+H2O
②生成的无色不稳定的物质受热分解 ③前者是物理变化,后者是化学变化
④没有进行尾气处理
【反思提高】将褪色后的溶液加热,观察溶液颜色变化,若溶液恢复为红色,则此结论
是正确的,若溶液不能恢复为红色,则此结论不正确(2分)

Ⅰ.制取氧化铜
①称取2gCuSO4?5H2O研细后倒入烧杯,加10mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不不规则产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀传问变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用.
回答下列问题:
(1)上述实验①、③步骤中需要使用玻璃棒的是
(2)步骤、中研磨固体所用仪器的名称是
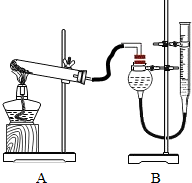
Ⅱ.证明氧化铜能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较用如图装置进行实验,实验时均以生成25mL
 气体为准,其它可能影响实验的因素均已忽略.相关数据见下表:
气体为准,其它可能影响实验的因素均已忽略.相关数据见下表:| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤ | 1.2g | 0.5g CuO | |
| ⑥ | 1.2g | 0.5g MnO2 |
(4)为探究CuO在实验⑤中是否起催化作用,需补做以下实验(无需写出具体操作):
a.
b.检验CuO的化学性质是否改变.
c.查阅资料后了解,MnO2对KClO3的催化过程由以下三个反应组成,请将第二个反应补充完整.
a.KClO3+2MnO2=2KMnO4+Cl2+O2↑
b.2KMnO4→K2MnO4+
c.K2MnO4+Cl2=2KCl+MnO2+O2↑
Ⅰ.请你完成他们制取氧化铜的实验步骤.
(1)称取10克胆矾,将其放入小烧杯中,再______.
(2)向步骤(1)中的烧杯内滴加______溶液,直至产生大量的沉淀.
(3)检验硫酸铜是否被作用完全,操作方法是______
______.
(4)将步骤(2)所得的混合物加热至沉淀全部变为黑色氧化铜.
(5)再将步骤(4)所得混合物过滤、洗涤、烘干后研细;验证是否洗净沉淀中硫酸根离子的方法是______
______.
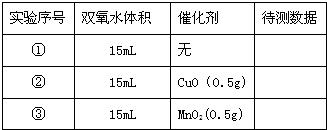
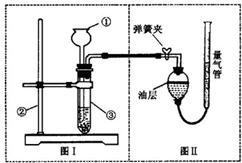
Ⅱ.小明设计了如图实验装置来证明氧化铜能加快双氧水(浓度约7%)的分解并与二氧化锰的催化效果进行比较(即比较反应速率).用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| ① | 15mL | 无 | |
| ② | 15mL | CuO(0.5g) | |
| ③ | 15mL | MnO2(0.5g) |

(1)从设计装置来看,有一个明显的缺陷,你认为如何纠正______.
(2)从设计原理看,实验中的“待测数据”可以是指______.
(3)实验时气体收集在图Ⅱ的球型漏斗中.若要保证读取的气体体积没有误差,在读数前应进行的操作是______.若要检验产生的气体是氧气,应打开单孔橡皮塞,______.
(4)为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验(不必写具体操作):a.证明CuO的化学性质没有改变;b.______.
Ⅲ.为证明氧化铜的化学性质在加入双氧水前后没有发生改变,你设计验证的实验是______.