题目内容
【题目】某研究性学习小组为了测定黄铜(铜、锌合金)的组成。在化学老师的帮助下,选用98%的浓硫酸、黄铜样品进行下列实验和计算。
(1)实验Ⅰ:配制150g9.8%的稀硫酸。
①计算:需要浓硫酸的质量g,约8.2mL;需要水的体积为mL。
②量取浓硫酸和水:量取液体时要准确量取。如果量取98%的浓硫酸时俯视读数,会导致所配溶液溶质质量分数9.8%。(填“大于”、“小于”或“等于”)。
③稀释
④装瓶贴标签:请填写下面的标签。![]()
(2)实验Ⅱ:测定黄铜样品中铜的质量分数。称取黄铜样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如图所示。试计算: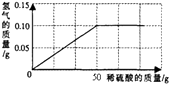
①产生氢气的质量为g;
②样品中铜的质量分数;
③反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)。
【答案】
(1)15,135,小于,![]()
(2)0.1,67.5%,15.1%
【解析】实验Ⅰ:①.溶质的质量=溶液的质量×溶质的质量分数,在稀释过程中溶质的质量不变,设需要浓硫酸的质量为x,150g×9.8%=x×98%;x=15g,需要水的质量为:150g-15g=135g,即135ml;②量取浓硫酸和水:量取液体时要准确量取。如果量取98%的浓硫酸时俯视读数,会导致读数偏大,实际液体的量偏少,所配溶液溶质质量分数小于9.8%。④装瓶贴标签:标签内容有:溶液的名称和浓度;实验Ⅱ:由图可知产生氢气的质量为0.1g;设样品中锌的质量为x,生成硫酸锌的质量为y,则
Zn + H2SO4 = | ZnSO4 + | H2↑ |
65 | 161 | 2 |
x | y | 0.1g |
65/x=2/0.1g x=3.25g
161/y=2/0.1g y=8.05g
样品中铜的质量分数=(10g-3.25g)÷10g×100%= 67.5%
反应后所得溶液中溶质的质量分数=8.05g÷(3.25g+50g-0.1g) ×100%≈15.1%
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案