题目内容
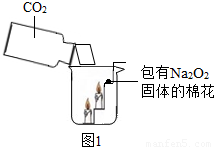
过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.(1)实验过程中“下面的蜡烛先熄灭,上面的蜡烛后熄灭”的现象说明二氧化碳具有______、______的性质.
(2)棉花为什么会燃烧呢?小组同学认为棉花要燃烧,除了满足“棉花是可燃物”这一条件,还另需满足a:______、b:______两个条件.
[提出问题]:在上述实验中是如何给棉花提供a和b这两个燃烧条件的呢?
[查阅资料]:(1)在常温下Na2O2能和CO2发生化学反应.
(2)在常温下Na2O2能和水发生反应:2Na2O2+2H2O═4NaOH+O2↑
(3)无水硫酸铜为白色固体,吸水后变为蓝色.
[设计实验]:经过讨论后,小组同学设计了如图2的实验进行探究.

[实验步骤]:①检查整套装置的气密性;②把相关的试剂放入对应的仪器内(D装置的U型管内放有足量的Na2O2固体,烧杯内盛有饱和的澄清石灰水),并按图2组装整套实验仪器;③用力推动针筒的活塞,把稀盐酸注入试管内;④一段时间后,在P处放置一根带火星的小木条,观察现象.
注:整个实验中不考虑稀盐酸的挥发和空气对实验的影响.
[实验现象]:①无水硫酸铜没有变蓝色;②带火星的小木条复燃;
③饱和的澄清石灰水变浑浊.
[实验分析]:①检查整套装置的气密性的方法:____________.
②C装置无水硫酸铜的作用是______.
③D装置的烧杯内饱和的澄清石灰水的作用是______.
[得出结论]:(1)①“小木条复燃”说明Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件;②______(填装置出现的现象)说明Na2O2和CO2反应使图1中的棉花满足了燃烧的另一个条件.
(2)Na2O2和CO2反应除生成一种气体外,还生成了一种固体,甲认为生成的固体是NaOH,乙认为是Na2CO3,同学们经过思考后认为甲同学的猜想是错误的,理由是:______.
(3)Na2O2和CO2反应的化学方程式是______.
[拓展提高]:现有一包保存不当的过氧化钠粉末,已证明其已完全变质.为探究其成分,有同学设计了以下定性和定量两种实验方案,请你帮助完成下列实验报告.
一、定性方案:
| 实验方案 | 实验现象 | 实验结论 |
| ①取样,先向溶液中滴加过量的________溶液. | 产生白色沉淀 | 粉末中既有NaOH也有Na2CO3 |
| ②静置,取上层清液,滴加________溶液. | 产生蓝色沉淀 |
称取39.8g样品于一只质量为45g的锥形瓶中,一次性加入20mL蒸馏水后将锥形瓶放置在电子天平上,逐滴滴加溶质质量分数为9.8%的稀硫酸,观察显示数字的变化,并绘制出混合溶液的质量与所滴入稀硫酸溶液的质量关系曲线(如图);请你根据曲线计算出粉末中各成分的质量.

【答案】分析:(1)探究过氧化钠与二氧化碳反应的产物及有关性质,本题检查装置的气密性是难点,关键是要抓住整套装置的“一头一尾”,检查的方法可以是先在U型管内装入水,使U型管左右液面保持相平,然后向下推针筒活塞,若U型管左边液面下降,右边液面上升,并稳定一段时间则说明气密性良好;对于装置中的药品的作用,要结合实验目的来推断,如:C装置无水硫酸铜的作用就是证明CO2中的水蒸气确实已被除去(2)定性定量探究部分,产生白色沉淀,生成了碳酸钙,产生了蓝色沉淀,生成了氢氧化铜沉淀,故选用、①CaCl2溶液②CuCl2溶液;计算部分,根据题意列式即可.
解答:解:问题(1)根据蜡烛熄灭的情况,可以比较简单地得出二氧化碳不支持燃烧、密度比空气大的结论.问题(2)要根据物质燃烧的条件,认识到燃烧必须棉花充分与氧气接触、温度必须达到棉花的着火点.为了探究图1实验中是如何给棉花提供这两个燃烧条件的,先通过图2中的A装置制取一定量的二氧化碳,并用浓硫酸吸收二氧化碳气体中混有的水蒸气,再通过“无水硫酸铜没有变蓝色”证明CO2中的水蒸气确实已被除去,到达D装置U型管内的气体是干燥的CO2气体,然后在P处的带火星的小木条复燃,说明Na2O2和CO2反应产生了氧气,可使棉花满足了与氧气充分接触的条件,饱和澄清石灰水中析出氢氧化钙固体,说明Na2O2和CO2反应放出热量,并足以使棉花的温度达到着火点.装置的气密性检查的方法是:先在U型管内装入水,使U型管左右液面保持相平,然后向下推针筒活塞,若U型管左边液面下降,右边液面上升,并稳定一段时间则说明气密性良好.定性定量探究部分,产生白色沉淀,生成了碳酸钙,产生了蓝色沉淀,生成了氢氧化铜沉淀,故选用、①CaCl2溶液②CuCl2溶液;计算部分,根据题意列式即可.
故答案为:实验(1)密度比空气大、不支持燃烧;(2)棉花充分与氧气接触、温度必须达到棉花的着火点;[实验分析]:①先在U型管内装入水,使U型管左右液面保持相平,然后向下推针筒活塞,若U型管左边液面下降,右边液面上升,并稳定一段时间则说明气密性良好.②证明CO2中的水蒸气确实已被除去③若析出氢氧化钙固体,说明Na2O2和CO2反应放出热量[得出结论]:(1)③饱和的澄清石灰水变浑浊(2)没有水参与反应(3)2Na2O2+2CO2═2Na2CO3+O2↑[拓展提高]:一、①CaCl2溶液②CuCl2溶液二、根据题意:稀硫酸先与NaOH反应,用掉100g,再Na2CO3与反应,用去300g稀硫酸,列式计算:
关系式:2NaOH--H2SO4 Na2CO3--H2SO4
80 98 106 98
m1 9.8%×100 m2 9.8%×300 解之得:m1=8g m2=31.8g 答:略.
点评:本题是探究燃烧的条件,以包有过氧化钠固体的棉花自燃为设计载体,定性、定量研究不纯的过氧化钠的组成.
解答:解:问题(1)根据蜡烛熄灭的情况,可以比较简单地得出二氧化碳不支持燃烧、密度比空气大的结论.问题(2)要根据物质燃烧的条件,认识到燃烧必须棉花充分与氧气接触、温度必须达到棉花的着火点.为了探究图1实验中是如何给棉花提供这两个燃烧条件的,先通过图2中的A装置制取一定量的二氧化碳,并用浓硫酸吸收二氧化碳气体中混有的水蒸气,再通过“无水硫酸铜没有变蓝色”证明CO2中的水蒸气确实已被除去,到达D装置U型管内的气体是干燥的CO2气体,然后在P处的带火星的小木条复燃,说明Na2O2和CO2反应产生了氧气,可使棉花满足了与氧气充分接触的条件,饱和澄清石灰水中析出氢氧化钙固体,说明Na2O2和CO2反应放出热量,并足以使棉花的温度达到着火点.装置的气密性检查的方法是:先在U型管内装入水,使U型管左右液面保持相平,然后向下推针筒活塞,若U型管左边液面下降,右边液面上升,并稳定一段时间则说明气密性良好.定性定量探究部分,产生白色沉淀,生成了碳酸钙,产生了蓝色沉淀,生成了氢氧化铜沉淀,故选用、①CaCl2溶液②CuCl2溶液;计算部分,根据题意列式即可.
故答案为:实验(1)密度比空气大、不支持燃烧;(2)棉花充分与氧气接触、温度必须达到棉花的着火点;[实验分析]:①先在U型管内装入水,使U型管左右液面保持相平,然后向下推针筒活塞,若U型管左边液面下降,右边液面上升,并稳定一段时间则说明气密性良好.②证明CO2中的水蒸气确实已被除去③若析出氢氧化钙固体,说明Na2O2和CO2反应放出热量[得出结论]:(1)③饱和的澄清石灰水变浑浊(2)没有水参与反应(3)2Na2O2+2CO2═2Na2CO3+O2↑[拓展提高]:一、①CaCl2溶液②CuCl2溶液二、根据题意:稀硫酸先与NaOH反应,用掉100g,再Na2CO3与反应,用去300g稀硫酸,列式计算:
关系式:2NaOH--H2SO4 Na2CO3--H2SO4
80 98 106 98
m1 9.8%×100 m2 9.8%×300 解之得:m1=8g m2=31.8g 答:略.
点评:本题是探究燃烧的条件,以包有过氧化钠固体的棉花自燃为设计载体,定性、定量研究不纯的过氧化钠的组成.

练习册系列答案
相关题目


 23、呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂.下面是兴趣小组同学围绕过氧化钠进行的一系列探究,请你参与到其中.
23、呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂.下面是兴趣小组同学围绕过氧化钠进行的一系列探究,请你参与到其中.
