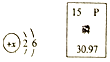��Ŀ����
����Ŀ���ס����������ʵ��ܽ��������ͼ��ʾ����ش��������⣺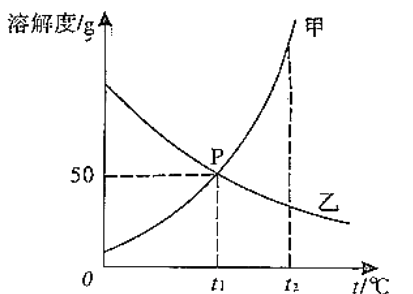
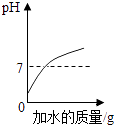
��1��t1��ʱ��150g�ı�����Һ���������ʵ�����Ϊ��
��2��������ʹ����ס����ҡ����IJ�������Һ��ɱ�����Һ�������л��������ļף��ᴿ�ҿɲ�ȡ�ķ�����
��3������˵������ȷ���� ��
A.t1��ʱ���������ļס��Ҳ�������Һ������t2�棬������Һһ����������������
B.t1��ʱ���������ļס��ұ�����Һ����������������ˮ������������������
C.t2��ʱ���������ס��ҷֱ���ɱ�����Һ����ȫ�ܽ�����ˮ�������ף���
D.��t2��ʱ�ס��ҵı�����Һ������t1�棬���üס�����Һ����������������ȣ�
���𰸡�
��1��50g
��2���ף�����
��3��B
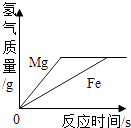
���������⣺��1��t1��ʱ���ܽ����50g����100gˮ������ܽ�50g�ļף��γɱ�����Һ150g����2�����ܽ�����¶����߶������ҵ��ܽ�����¶����߶���С�����ԼIJ�������Һ��Ϊ������ҺӦ��ȡ���µķ����������л��������ף��ɲ�ȡ���µķ���ʹ���������ᴿ����3��A��t1��ʱ���������ļס��Ҳ�������Һ������t2�棬���ܽ���������������壬�ҵ��ܽ�ȼ�С���������壬�ʴ���
B��t1��ʱ���ҵ��ܽ����ȣ���������ˮ������ܽ�����ʵ�������ȣ����Ե������ļס��ұ�����Һ����������������ˮ�����������������ȣ���ȷ��
C��t2��ʱ���ܽ�ȴ����ң�����������ˮ���ܽ�ļ����������ң����Ե������ס��ҷֱ���ɱ�����Һ����ȫ�ܽ�����ˮ��������С���ң��ʴ���
D����t2��ʱ�ס��ҵı�����Һ������t1�棬���������壬���ܽ�ȱ����Һ�����ʡ��ܼ����������䣬�뽵��ǰ��ȣ��ݱ�����Һ�����ʵ����������ļ���ʽ ![]() ��100%��֪���ܽ�ȴ������ʵ�����������t1����ܽ�ȴ��ڽ���ǰ�ҵ��ܽ�ȣ������ü�����������������Һ�����������������ʴ���
��100%��֪���ܽ�ȴ������ʵ�����������t1����ܽ�ȴ��ڽ���ǰ�ҵ��ܽ�ȣ������ü�����������������Һ�����������������ʴ���
��ѡ��B��
��1���ݸ��¶��¼��ܽ�ȷ�����𣻣�2�����ܽ�����¶����߶������ҵ��ܽ�����¶����߶���С���ݴ˷�����𣻣�3���ݼ����ܽ�����¶ȱ仯�����������Һ�����ʵ������������㷽�����

 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д� �����Ծ���Ԫ���Ծ�ϵ�д�
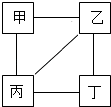
�����Ծ���Ԫ���Ծ�ϵ�д�����Ŀ���ס��ҡ��������������ʵ����Ӧ��ϵ��ͼ��ʾ����������ʾ���������ʼ��ܷ�����Ӧ�����з��϶�Ӧ��Ӧ��ϵ��ѡ���ǣ� ��
ѡ�� | A | B | C | D | |
�� | �� | Ca��OH��2 | CO2 | H2 | Fe |
�� | Na2CO3 | NaOH | O2 | HCl | |
�� | H2SO4 | CaCl2 | CuO | CuSO4 | |
�� | BaCl2 | AgNO3 | HCl | NaOH | |
A.A
B.B
C.C
D.D