题目内容
【题目】为液体,D为无色气体,F是白色难溶固体,其中金属元素的质量分数为40%.它们之间有如图所示的转化关系(部分物质和反应条件已略去).
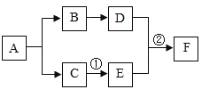
(1)A为__________________,
(2)E物质在生活中的一种用途是__________________,
(3)反应②的化学方程式为____________________________________.
【答案】过氧化氢溶液(或H2O2) 改良酸性土壤或做建筑材料等 CO2+Ca(OH)2=CaCO3↓+H2O
【解析】
A、C是组成元素完全相同的化合物,C通常为液体,A可以反应生成B和C,因此A为过氧化氢,C为水,B是氧气;氧气反应产生的D是气体,D和F反应产生的F,F是一种难溶性的白色固体,其中金属元素的质量分数为40%,因此F是碳酸钙,则D是二氧化碳,E是氢氧化钙,反应①为水和氧化钙的反应产生氢氧化钙,至此各物质鉴定完毕,带入验证符合题意。
根据以上分析可知:
(l)A为过氧化氢溶液(或H2O2);
(2)E是氢氧化钙,可以改良酸性土壤或做建筑材料等;
(3)反应②是二氧化碳和氢氧化钙反应产生碳酸钙沉淀和水;故反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】酸、碱、盐是三类重要物质.
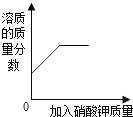
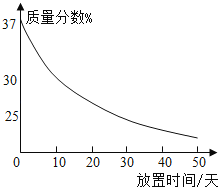
(1)实验室中有一瓶敞口放置的浓盐酸.它的质量分数和放置天数的关系如图.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因_____.
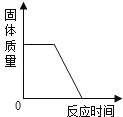
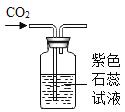
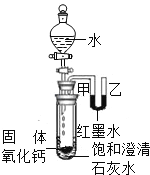
(2)观察图片,向小试管内滴加水后,除看到氧化钙固体溶解外,还可观察到的现象是_____.解释产生此现象的原因_____;_____.
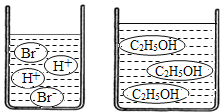
(3)如图分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显_____,乙醇的水溶液显_____(填“酸性”、“中性”或“碱性”).
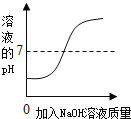
(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
加入NaOH溶液的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.5 | 7.0 | 11.0 | 12.0 |
①若滴加的指示剂是紫色石蕊溶液,当加入氢氧化钠溶液的体积为13mL时,溶液显_____色.
②若滴加指示剂是无色酚酞溶液,入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式)_____;可能有_____.