题目内容
【题目】图一、图二是某兴趣小组探究金属的活动性顺序及盐与盐的反应时所做的两组实验。实验结束后,将两组实验试管中的物质分别全部倒入甲、乙两个洁净的烧杯中,据图回答:
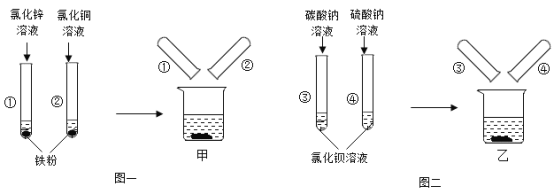
(1)图一所示的实验中,试管②中发生反应的化学方程式为_________________。
(2)甲烧杯中充分反应后,发现烧杯中的红色固体物质明显增多,下列说法正确的是____________。
A 试管②反应后固体中一定只有铜
B 甲烧杯固体中一定没有铁
C 甲烧杯液体中一定含有Zn2+、 Fe2+、Cu2+
(3)小组同学将图二乙烧杯中的物质过滤后,对所得滤液中溶质的成分进行了如下探究:
[提出问题]滤液里除了NaCl外,还可能有哪些溶质
[作出猜想]猜想①: Na2CO3
猜想②; Na2SO4
猜想③: Na2CO3、 Na2SO4
猜想④:______________
[实验探究]
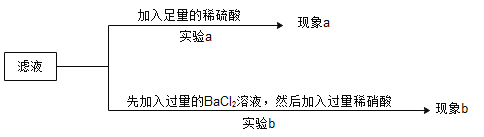
i.若“现象a”只有白色沉淀,则猜想___________成立;若“现象a”只有气泡产生,则猜想_________可能成立;
ii.若“现象b”为先产生白色沉淀,后沉淀部分溶解并产生气泡,则猜想____________成立;若“现象b”为先产生白色沉淀,沉淀全部不溶解,则产生该不溶沉淀的反应方程式为___________。
[反思评价]有一位同学认为只需进行实验b就能验证以上所有猜想,小组其他同学否定了他的设想,原因是___________。
【答案】![]() A BaCl2 ④ ①③ ③
A BaCl2 ④ ①③ ③ ![]() b无法验证是否有氯化钡的存在
b无法验证是否有氯化钡的存在
【解析】
(1)试管②中发生反应是铁与氯化铜反应生成铜和氯化亚铁,化学方程式为![]() 。
。
(2) A、甲中红色固体增多,说明试管②反应后氯化铜有剩余,则铁粉反应完,固体中一定只有铜,A正确;
B、甲中红色固体增多,说明甲烧杯中有氯化铜和铁反应,铁不一定反应完,则甲烧杯固体中可能含有铁,B不正确;
C、甲中红色固体增多,说明甲烧杯中有氯化铜和铁反应,氯化铜不一定反应完,则甲烧杯中可能含有氯化铜,因此,甲烧杯液体中一定含有没有参与反应的Zn2+,还有生成的Fe2+,可能还有剩余的Cu2+,C不正确。故选A。
(3) 作出猜想:
如果碳酸钠和硫酸钠都完全反应,还有氯化钡剩余,则猜想④是氯化钡。
实验探究:
i 若“现象a”只有白色沉淀,硫酸与氯化钡反应产生硫酸钡白色沉淀,说明滤液中含有氯化钡,不含碳酸钠或硫酸钠,则猜想④成立;
若“现象a”只有气泡产生,硫酸与碳酸钠反应生成二氧化碳气体,说明滤液中含有碳酸钠,可能含有硫酸钠,一定不含氯化钡,则猜想①③可能成立;
ii若“现象b”为先产生白色沉淀,后沉淀部分溶解并产生气泡,说明沉淀既有硫酸钡又有碳酸钡,硫酸钡不溶于酸,碳酸钡溶于酸,滤液中含有硫酸钠和碳酸钠,则猜想③成立;
若“现象b”为先产生白色沉淀,沉淀全部不溶解,说明只生成硫酸钡沉淀,没有生成碳酸钡沉淀,滤液含有硫酸钠,不含碳酸钠,则产生该不溶沉淀的反应方程式为![]() 。
。
反思评价:
有一位同学认为只需进行实验b就能验证以上所有猜想,小组其他同学否定了他的设想,原因是实验b无法验证是否有氯化钡的存在。

【题目】用化学式填空(要求:化学式中的元素种类和化合价,都限于下表所列)。
元素名称 | 氢 | 碳 | 氧 | 钙 |
化合价 | +1 | +4 | -2 | +2 |
(1)金属氧化物_____;
(2)一个分子中含有多个氧原子的非金属氧化物_____;
(3)酸_____;
(4)碱_____。